
|
|
|||||
|
||||||
華海藥業奪500億市場新國內龍頭 31個新品沖刺上市摘要:
今年上半年華海藥業碩果不斷:11款高端仿制藥獲批上市,優勢領域高血壓用藥再添多個重磅新品,1類新藥HHT109膠囊首次申報臨床并獲批。目前公司已有10多款1類新藥進入臨床階段,進展順利;31個新品上市在即,其中5個產品有望爭奪國內首仿,5個亞類市場將迎來新突破。備受市場關注的第九批國采蓄勢待發,華海藥業4大產品積極備戰。
奪高血壓用藥新國內龍頭,上半年11款新品獲批
米內網數據顯示,2022年在中國城市公立醫院、縣級公立醫院、城市社區中心及鄉鎮衛生院(簡稱中國公立醫療機構)終端,高血壓用藥的市場規模保持在500億元以上。浙江華海藥業從2015年的TOP18企業一路攀升至2022年的TOP5,排在阿斯利康、拜耳、諾華和輝瑞之后,成為新的國內龍頭。
表1:華海藥業進入2022年高血壓用藥TOP20品牌的產品
 來源:米內網中國公立醫療機構藥品終端競爭格局
厄貝沙坦氫氯噻嗪片是華海藥業在高血壓用藥市場的拳頭產品,在中國公立醫療機構終端的銷售額一路飆漲,2015年突破1億元,2020年漲至5億元以上,2022年再創新高達6.55億元。隨著產品銷售額不斷提升,公司的市場地位也水漲船高,公司在2022年成為了厄貝沙坦氫氯噻嗪片新的領軍企業,市場份額達到38.60%。
公司的氯沙坦鉀片也從2013年的9000萬元水平一路漲至2021年的6.71億元,2022年下滑18.07%,但公司依然領軍市場,市場份額達到46.51%。
表2:華海藥業今年以來獲批上市的新品
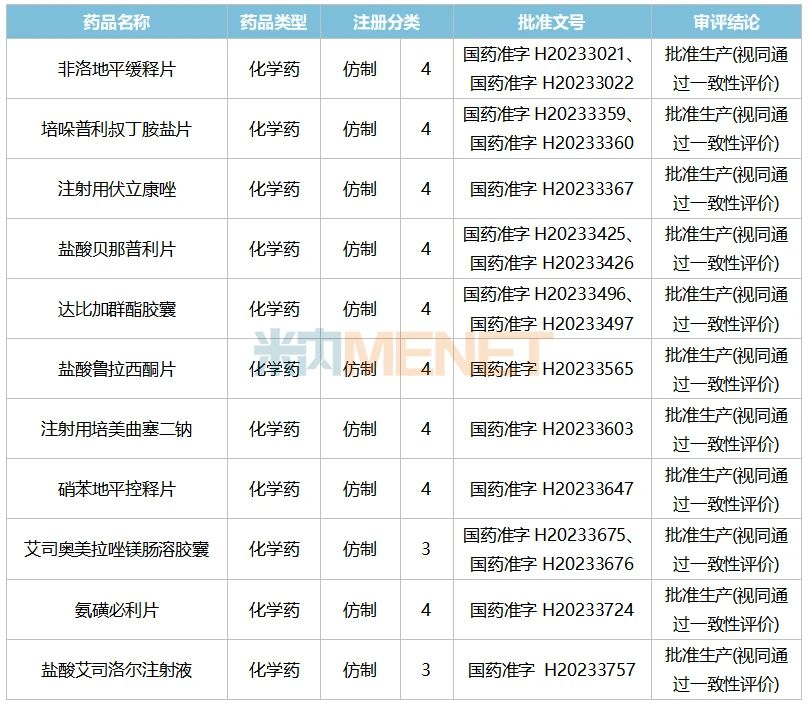 來源:米內網中國申報進度(MED)數據庫
2023年1-6月華海藥業獲批上市的新品有11款,其中高血壓用藥涉及非洛地平緩釋片、培哚普利叔丁胺鹽片、鹽酸貝那普利片、硝苯地平控釋片和鹽酸艾司洛爾注射液。2022年在中國公立醫療機構終端,硝苯地平控釋片和非洛地平緩釋片的銷售額分別超過了58億元、26億元,華海藥業拿下高血壓用藥大品種,不僅豐富了公司的產品矩陣,未來借助公司已有的品牌實力,新品上市后的成績同樣值得期待。
此外,華海藥業近幾年還在不斷開拓新領域,公司早前暫無抗腫瘤藥和治療與胃酸分泌相關疾病的藥物獲批,今年剛獲批的注射用培美曲塞二鈉是公司首款上市的抗腫瘤藥,而艾司奧美拉唑鎂腸溶膠囊則是公司首款上市的PPI抑制劑,隨著新市場大門打開,公司的整體競爭實力進一步提升。
研發投入沖破12億,超10款1類新藥快速推進
據華海藥業年報數據顯示,近幾年公司的研發投入持續增長,2021年突破10億元,2022年超過12億元,研發投入占營業收入比例保持在10%以上,研發實力在業內名列前茅。
圖1:華海藥業近幾年的研發投入情況(單位:億元)
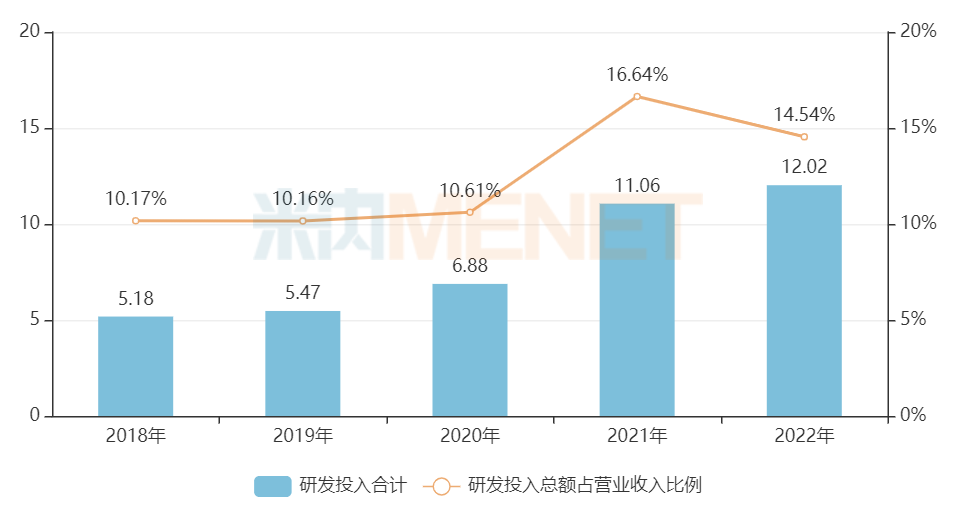 來源:公司年報
華海藥業堅持創新驅動發展,在豐富現有研發管線、加快投入產出速度以充實產品儲備的同時,著眼未來發展趨勢,積極拓寬生物藥、小分子新藥等研發產品領域,培育公司長期發展的核心競爭力。
表3:華海藥業及子公司今年以來申報的新藥情況
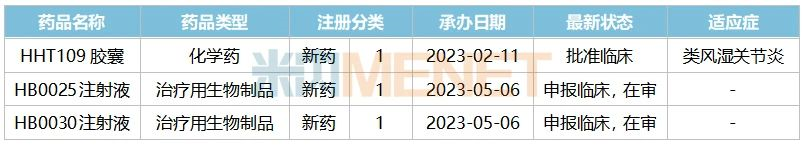 來源:米內網中國申報進度(MED)數據庫
今年以來華海藥業已提交了3款1類新藥的臨床申請,其中HHT109膠囊為首次申報,獲批適應癥為類風濕關節炎。
表4:華海藥業及子公司部分已進入臨床的重磅1類新藥情況
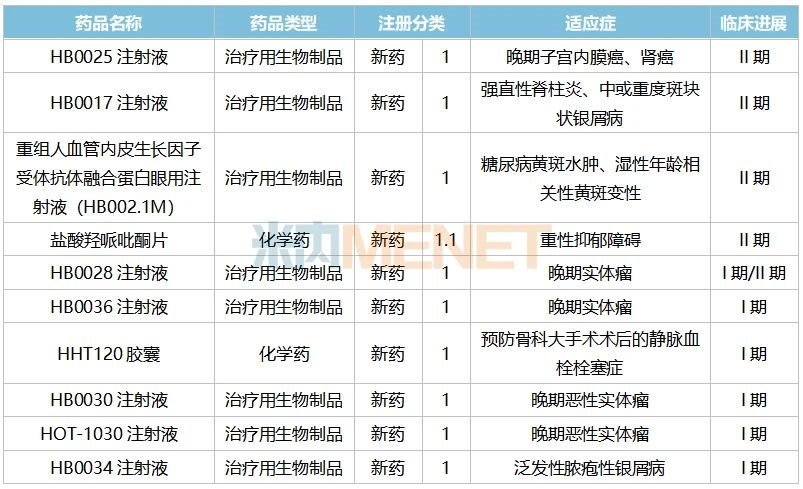 來源:公司公告、米內網中國臨床試驗數據庫
目前華海藥業已有多款1類新藥進入臨床階段,其中生物藥的占比較大。臨床進度較快的有HB0025注射液、HB0017注射液、HB002.1M已在II期臨床階段,HB0028注射液也在I期/II期,最終誰能成為公司首款報產的生物藥1類新藥,我們拭目以待。
華海藥業在年報中提到,公司未來在生物藥板塊繼續推進研發工作的同時,積極探索單藥和聯合用藥的多種策略,建設有競爭力和差異化的產品布局。
50個產品已過評,31個爆款沖刺上市
華海藥業是最早一批參與一致性評價工作的藥企,2017年12月對外公布的《通過仿制藥質量和療效一致性評價藥品的公告(第一批)》中,公司的鹽酸帕羅西汀片、利培酮片、福辛普利鈉片、厄貝沙坦氫氯噻嗪片、厄貝沙坦片、賴諾普利片和氯沙坦鉀片共7個產品通過一致性評價,截至目前公司已過評/視同過評的產品達50個。
表5:華海藥業已過評/視同過評的產品
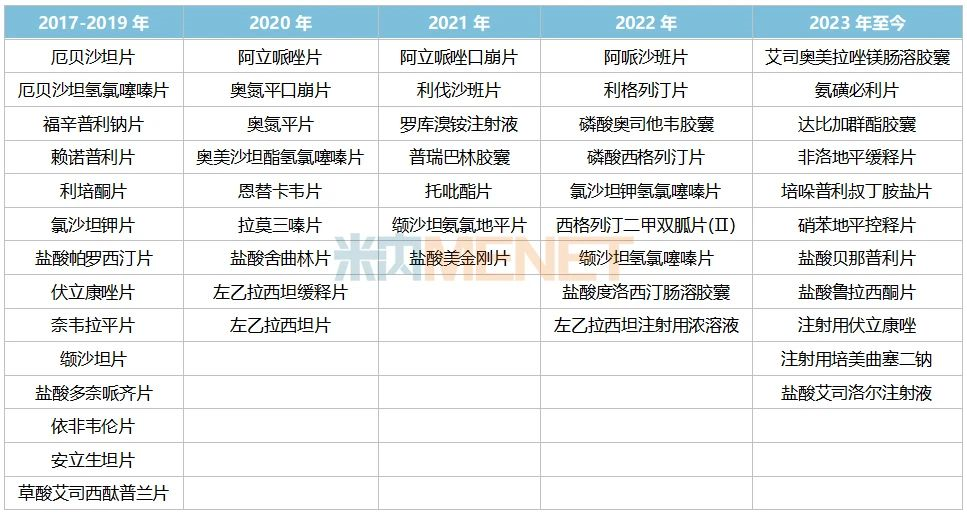 來源:米內網中國申報進度(MED)數據庫
華海藥業積極參與國家集中帶量采購,從4+7試點到第八批國采共有21個產品中標,其中高血壓用藥占了9個,精神安定藥占了4個,精神興奮藥占了3個,全身用抗真菌藥占了2個,肌肉松弛藥、抗血栓形成藥、全身用抗病毒藥各占1個。
公司已過評且暫未納入國采目錄的產品有10個,其中4個產品目前的競爭企業數量≥5家(含原研+過評),利格列汀片和磷酸西格列汀片2022年在中國公立醫療機構終端的銷售額均超過10億元,奧美沙坦酯氫氯噻嗪片、西格列汀二甲雙胍片(Ⅱ)也是億元級別的暢銷產品,華海藥業上述產品目前的市場份額較低或未開始放量,若最終納入第九批國采并順利中標,將助力公司快速拓展市場。
表6:2021年至今華海藥業及子公司報產在審的產品情況
 來源:米內網中國申報進度(MED)數據庫
2021年至今,華海藥業共有31個高端仿制藥申報上市并在審,其中多巴絲肼片、富馬酸二甲酯腸溶膠囊、二甲雙胍恩格列凈片(Ⅴ)、二甲雙胍恩格列凈片(Ⅵ)以及卡左雙多巴緩釋片目前暫未有國產仿制藥獲批(不含原研地產化),華海藥業有望參與首仿爭奪戰。
此外,華海藥業目前暫未有抗帕金森氏病藥、抗痛風制劑、抗炎藥和抗風濕藥、泌尿系統藥物、免疫抑制劑上市,新品獲批后將助力公司開拓新市場。
2022年在中國公立醫療機構終端免疫抑制劑的市場規模超過230億元,從申報時間來看,枸櫞酸托法替布片大概率能成為公司首款上市的免疫抑制劑,為公司成功撬開這個百億市場的大門。隨著新領域順利開拓,華海藥業的版圖將越來越大。
資料來源:米內網數據庫、公司公告
注:米內網《中國公立醫療機構藥品終端競爭格局》,統計范圍是:中國城市公立醫院、縣級公立醫院、城市社區中心以及鄉鎮衛生院,不含民營醫院、私人診所、村衛生室;上述銷售額以產品在終端的平均零售價計算。數據統計截至7月7日。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|