
|
|
|||||
|
||||||
恒瑞、君實(shí)、信達(dá)、百濟(jì)四雄爭(zhēng)霸 國(guó)內(nèi)PD-1市場(chǎng)戰(zhàn)火已燃摘要:
醫(yī)藥網(wǎng)6月6日訊 2018年4月23日,恒瑞PD-1單抗卡瑞利珠單抗注射液(Camrelizumab,SHR-1210)的上市申請(qǐng)(CXSS1800009)獲得CDE承辦受理,并擬被納入第28批優(yōu)先審評(píng),為烈火烹油的PD-1單抗研發(fā)競(jìng)賽再添了一把火。
恒瑞的PD-1單抗是目前第5家申報(bào)在國(guó)內(nèi)上市的PD-1單抗。在這之前,海外BMS的Opdivo和默沙東的Keytruda以及國(guó)內(nèi)君實(shí)生物和信達(dá)生物的PD-1單抗都已經(jīng)遞交上市申請(qǐng)。
其中BMS的Opdivo于2017年11月1日率先提交了上市申請(qǐng),成為第一個(gè)在中國(guó)申報(bào)上市的PD-1/PD-L1靶點(diǎn)藥物。而國(guó)內(nèi)首個(gè)申請(qǐng)由信達(dá)生物于2017年12月13日提交(之后撤回并于2018年4月19日重新遞交申請(qǐng))。
從全球來(lái)看,BMS、默沙東、羅氏以及阿斯利康為第一梯隊(duì);從國(guó)內(nèi)來(lái)看,同樣是四雄爭(zhēng)先,分別是恒瑞醫(yī)藥、信達(dá)生物、君實(shí)生物及百濟(jì)神州。除百濟(jì)神州因開展國(guó)際多中心臨床試驗(yàn)可能上市進(jìn)度較慢以外,另外三家均已經(jīng)上報(bào)上市申請(qǐng)。
值得注意的是,國(guó)內(nèi)PD-1/PD-L1 藥物研發(fā)火爆,在研PD-1/PD-L1 藥物達(dá)30個(gè),目前CFDA公示的即將進(jìn)行或正在進(jìn)行的臨床試驗(yàn)達(dá)60多例。PD-1藥物是中國(guó)創(chuàng)新藥企的一次集體亮相,也將考驗(yàn)企業(yè)包括研發(fā)能力、生產(chǎn)能力和學(xué)術(shù)推廣能力在內(nèi)的全方位實(shí)力。
1.競(jìng)爭(zhēng)日趨激烈
全球共有5款PD-1/PD-L1單抗上市,總銷售額超過(guò)80億美元(見表1)。其中默沙東的Keytruda、BMS和小野制藥聯(lián)合開發(fā)的Opvido由于上市較早獲批適應(yīng)癥多,銷售額上占據(jù)領(lǐng)先優(yōu)勢(shì)。
BMS的Opdivo是全球首款獲FDA批準(zhǔn)的PD-1單抗藥物,其在2014年7月獲PMDA批準(zhǔn)上市,此后于2014年12月獲FDA批準(zhǔn),于2016年獲EMA批準(zhǔn)上市。
默沙東的Keytruda則是最先獲FDA批準(zhǔn)的PD-1單抗藥物,其于2014年9月獲FDA批準(zhǔn)上市,比Opdivo快3個(gè)月在美獲批,此后于2015年和2016年分別在歐洲和日本獲批。之后羅氏、阿斯利康及輝瑞分別推出了他們相應(yīng)的PD-L1單抗,加入PD-1市場(chǎng)的競(jìng)爭(zhēng)。
 從國(guó)內(nèi)藥企的PD-1單抗申報(bào)進(jìn)度上來(lái)看,信達(dá)、君實(shí)、恒瑞屬于第一梯隊(duì),百濟(jì)神州目前還未報(bào)產(chǎn)。
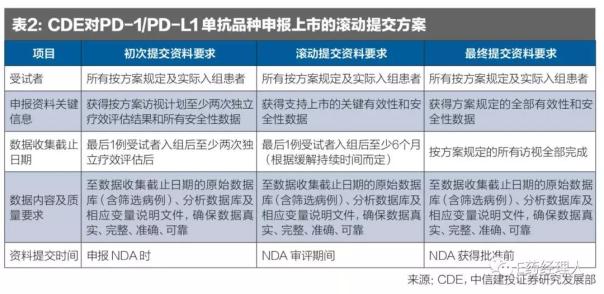
目前國(guó)內(nèi)已經(jīng)有超過(guò)25個(gè)品種進(jìn)行了PD-1/PD-L1單抗的臨床申請(qǐng),2018年2月8日,CDE發(fā)布《抗PD-1/PD-L1單抗品種申報(bào)上市的資料數(shù)據(jù)基本要求》,允許申報(bào)企業(yè)對(duì)以O(shè)RR為主要終點(diǎn)的研究結(jié)果進(jìn)行上市申請(qǐng)可進(jìn)行滾動(dòng)提交(見表2)。
之后信達(dá)生物主動(dòng)撤回之前的申報(bào),于2018年4月19日重新遞交申請(qǐng),而在此之間君實(shí)生物于3月20日提交了上市申請(qǐng)。同樣處于III期臨床階段的百濟(jì)神州目前尚未提交上市申請(qǐng)。
 從適應(yīng)癥上來(lái)看,目前恒瑞對(duì)于適應(yīng)癥的覆蓋更加全面,整體進(jìn)度更快。君實(shí)的JS001以黑色素瘤適應(yīng)癥進(jìn)行申報(bào),信達(dá)的適應(yīng)癥為霍奇金淋巴瘤。根據(jù)臨床試驗(yàn)開展的時(shí)間和用藥情況,推測(cè)此次恒瑞提交的SHR-1210大概率以經(jīng)典的霍奇金淋巴瘤適應(yīng)癥進(jìn)行申報(bào)。
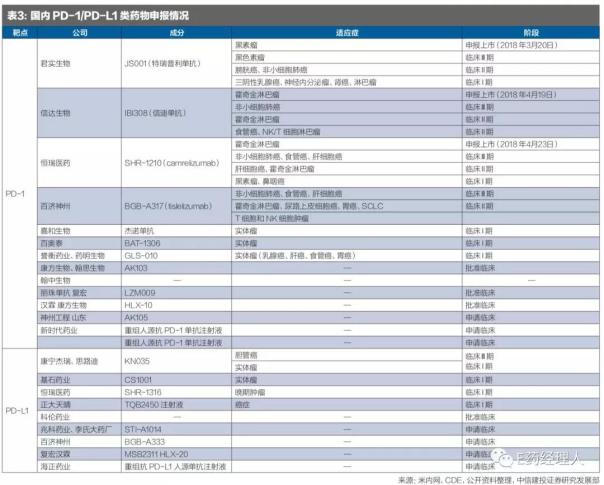 從臨床試驗(yàn)的適應(yīng)癥覆蓋上看,恒瑞在肝細(xì)胞癌、非小細(xì)胞肺癌以及食管癌適應(yīng)癥上都已經(jīng)進(jìn)入III期臨床,同時(shí)胃癌、NK/T細(xì)胞淋巴瘤、霍奇金淋巴瘤適應(yīng)癥進(jìn)行到II期臨床,相比于其他兩家公司在適應(yīng)癥的拓展上更具優(yōu)勢(shì)。
參考國(guó)外Opdivo和Keytruda的競(jìng)爭(zhēng)情況,適應(yīng)癥的擴(kuò)展對(duì)PD-1單抗類藥物的銷售尤為重要,恒瑞憑借自身雄厚的研發(fā)實(shí)力和規(guī)模優(yōu)勢(shì)在此方面具備一定的優(yōu)勢(shì)(見表3)。
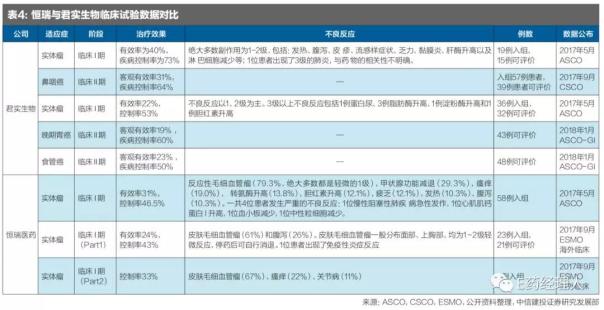
從臨床數(shù)據(jù)的對(duì)比上來(lái)看,恒瑞、君實(shí)、百濟(jì)神州的治療效果類似,恒瑞具有微血管瘤的副作用。
2017年6月,恒瑞醫(yī)藥在ASCO上發(fā)布了PD-1單抗I期的臨床數(shù)據(jù),29例食管鱗狀細(xì)胞癌ORR為34.48%;8例胃癌ORR為37.50%;3例肺癌中1例應(yīng)答;3例鼻咽癌中1例應(yīng)答;3例肝細(xì)胞癌中1例應(yīng)答;3例結(jié)直腸癌中1例應(yīng)答;1例膀胱癌應(yīng)答。總應(yīng)答率為31.0%,疾病控制率為46.5%。
對(duì)比君實(shí)和百濟(jì)神州的PD-1單抗,三者在治療效果上相似(見表4)。恒瑞的SHR-1210具有血管瘤的副作用,國(guó)內(nèi)I期試驗(yàn)中發(fā)生率為79%,海外I期試驗(yàn)中血管瘤發(fā)生率為61%,但是大部分屬于輕微的1級(jí)副作用,并沒有太大影響。
 2.優(yōu)先審評(píng)助力
國(guó)產(chǎn)三大PD-1單抗均納入優(yōu)先審評(píng),PD-1市場(chǎng)的競(jìng)爭(zhēng)更加激烈。CDE此次公布擬納入第28批優(yōu)先審評(píng)的藥物名單,恒瑞、君實(shí)、信達(dá)的PD-1單抗均因與現(xiàn)有治療手段相比具有明顯治療優(yōu)勢(shì)被納入。
在此之前,BMS的Opdivo已經(jīng)被納入優(yōu)先審評(píng)名單,此次恒瑞、君實(shí)、信達(dá)的加入,將為國(guó)產(chǎn)PD-1單抗藥物在國(guó)內(nèi)上市的時(shí)間提速。
BMS和默沙東的藥物由于已經(jīng)在海外上市,在安全性和有效性上更具保證;相對(duì)而言,國(guó)產(chǎn)藥物憑借公司在本土的優(yōu)勢(shì),在價(jià)格、銷售層面具備一定的優(yōu)勢(shì)。幾種藥物尤其是申報(bào)的時(shí)間相差無(wú)幾,國(guó)內(nèi)的PD-1藥物的市場(chǎng)競(jìng)爭(zhēng)將更加激烈。
提交NDA的1類新藥數(shù)目增加至4個(gè),創(chuàng)新藥戰(zhàn)略更近一步,對(duì)恒瑞醫(yī)藥而言,SHR-1210的申報(bào)和納入優(yōu)先審評(píng)意味著其創(chuàng)新藥的戰(zhàn)略又向前一步。
目前公司共有17個(gè)創(chuàng)新藥正在臨床開發(fā)的進(jìn)程中,多個(gè)創(chuàng)新藥處于III期臨床試驗(yàn)或申報(bào)生產(chǎn)階段,包括吡咯替尼、19K、法米替尼、SHR-1210等,其中吡咯替尼、19K、瑞馬唑侖已經(jīng)進(jìn)行上市申請(qǐng),吡咯替尼在2017年已經(jīng)進(jìn)入優(yōu)先審評(píng),有望在2018年獲批上市。
SHR-1210進(jìn)入上市申請(qǐng),恒瑞提交NDA的1類新藥數(shù)目增加到4個(gè),有2個(gè)屬于優(yōu)先審評(píng)。預(yù)計(jì)未來(lái)將形成每2~3年便有新藥獲批上市的良性可持續(xù)發(fā)展態(tài)勢(shì)。此前阿帕替尼的上市對(duì)于恒瑞抗腫瘤藥板塊的業(yè)績(jī)具有顯著的拉升作用,PD-1單抗由于適應(yīng)癥廣泛,未來(lái)國(guó)內(nèi)市場(chǎng)空間巨大。
|
|
友情鏈接
Copyright ?2015 廣東穗康醫(yī)藥有限公司
粵ICP備15022662號(hào)(粵)
-技術(shù)支持:信息管理部|聯(lián)系我們
|