
|
|
|||||
|
||||||
盤點被納入特別審批和優先審批程序的體外診斷產品摘要:
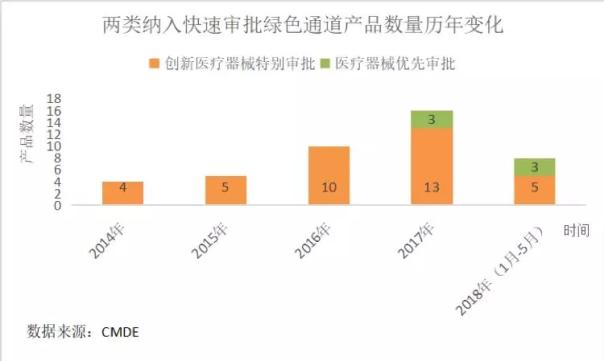
醫藥網6月7日訊 截止2018年5月31日,CMDE公示顯示已有183項產品被納入創新醫療器械特別審批通道,其中37項為體外診斷產品,占產品總數的16.94%;已有15項產品納入醫療器械優先審批通道,其中6項為體外診斷產品,占產品總數的40%。
根據《創新醫療器械特別審批程序》(食藥監械管〔2014〕13號)規定:創新醫療器械產品須符合主要工作原理/作用機理為國內首創,產品性能或者安全性與同類產品比較有根本性改進,技術上處于國際領先水平,并且具有顯著的臨床應用價值。
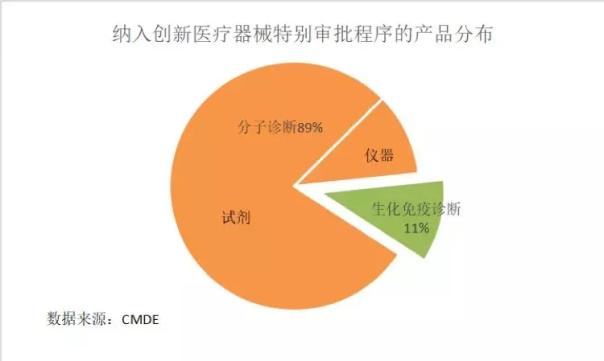 在公示的37項產品中,體外診斷試劑31項,體外診斷儀器6項。其中分子診斷產品以89%的絕對優勢占據主導地位,包括29項分子診斷試劑和4項分子診斷儀器。另外還有1項生化診斷試劑、1項免疫診斷試劑、1項免疫診斷儀器和1項生化免疫儀器被納入特別審批通道。
根據《醫療器械優先審批程序》(總局2016年第168號公告)規定:符合下列條件之一的醫療器械實施優先審批
(一)符合下列情形之一的醫療器械:
1.診斷或者治療罕見病,且具有明顯臨床優勢;
2.診斷或者治療惡性腫瘤,且具有明顯臨床優勢;
3.診斷或者治療老年人特有和多發疾病,且目前尚無有效診斷或者治療手段;
4.專用于兒童,且具有明顯臨床優勢;
5.臨床急需,且在我國尚無同品種產品獲準注冊的醫療器械。
(二)列入國家科技重大專項或者國家重點研發計劃的醫療器械。
(三)其他應當優先審批的醫療器械。
在公示的6項產品中,5項是符合上述條件二“列入國家科技重大專項或者國家重點研發計劃的醫療器械”的產品,1項是符合上述條件一“診斷或者治療罕見病,且具有明顯臨床優勢”;4項是免疫診斷產品,2項是分子診斷產品。
我國目前的體外診斷市場主要分為生化、免疫、分子三大類,相比于生化和免疫診斷,分子診斷的靈敏度更高,特異性更強,同時也有更高的技術壁壘。這些獲得特別審批或優先審批的產品,都是技術處于國際領先水平甚至填補了國內空白的產品。在大發展、大變革的環境下,技術的更新將持續改變現有的醫療技術,一批新興企業沖向了潮頭,在申請優先審批和特別審批的企業中就有14家企業無任何已上市產品,8家企業只有1-2項產品已上市。
 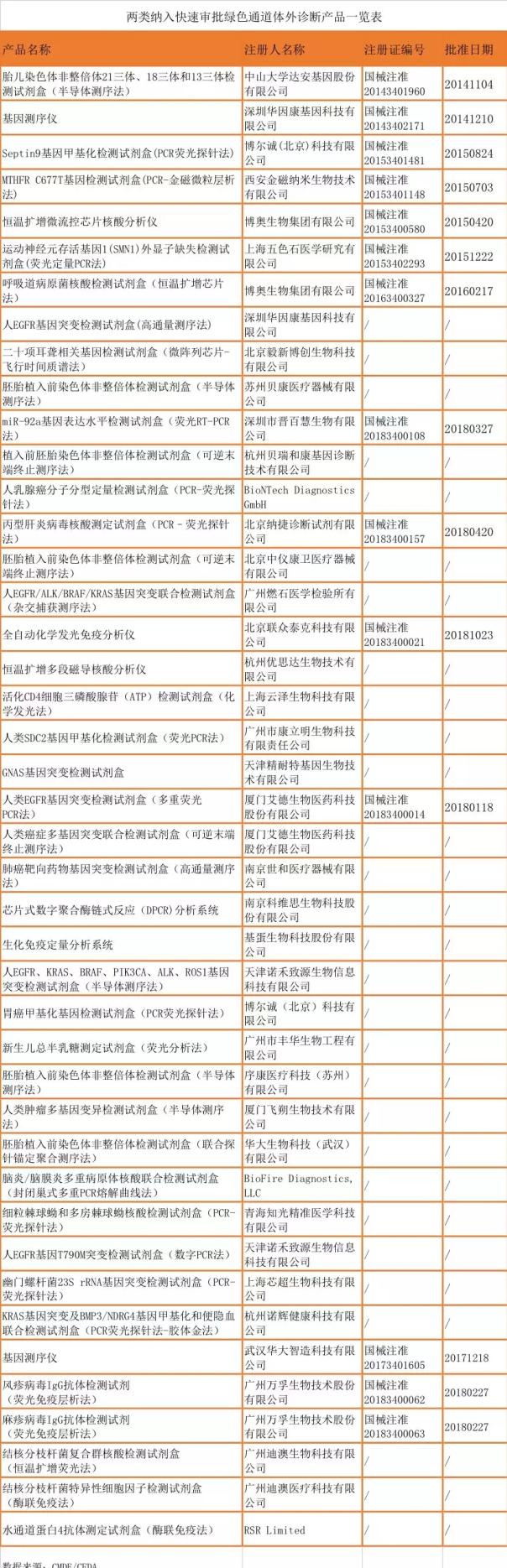 其中,廈門艾德生物醫藥科技股份有限公司產品人類EGFR基因突變檢測試劑盒(多重熒光PCR法)從2017年3月7日公示到2018年1月18日獲批歷時不到11個月,該產品基于擴增阻礙突變系統(Amplification Refractory Mutation System,ARMS)和熒光PCR技術實現血漿DNA樣本中6 / 18 EGFR突變基因的檢測。艾德生物2010年就獲得了人類EGFR基因21種突變檢測試劑盒(熒光PCR法)的產品注冊證,用于體外定性檢測腸癌和肺癌患者病理標本提取DNA的EGFR基因21種體細胞突變。人類EGFR基因突變檢測試劑盒(多重熒光PCR法)用于體外定性檢測晚期非小細胞肺癌(NSCLC)患者血漿DNA樣本中人類EGFR突變基因。相比于前者只能用于輔助診斷,后者是我國首個批準用于甲磺酸奧希替尼片的伴隨診斷檢測產品,可在臨床上為醫生提供明確指導。
深圳市晉百慧生物有限公司產品miR-92a基因表達水平檢測試劑盒(熒光RT-PCR法)從2016年6月6日公示到2018年3月27日獲批歷時近22個月,該產品是采用RNA提取試劑盒提取糞便中的RNA進行RT-PCR反應,反應中的引物、探針能夠與miR-92a反轉錄產物特異性結合并進行PCR擴增,在擴增過程中探針與含miR-92a模板的反轉錄cDNA鏈互補結合后,探針5’端熒光染料集團被Taq酶切下并釋放熒光信號,被檢測到的熒光信號強弱可以反映樣本中的miR-92a含量。產品用于體外定性檢測人糞便樣本中的miR-92a核酸。miR-92a對于大腸癌的輔助檢測是一個新的標志物,產品采集方便,檢測時間較短,具有較高的臨床價值。
從整體來看,產品數量呈現上升趨勢并集中于分子診斷領域,然而并不是所有納入綠色通道的產品都能百分之百順利通過審評,目前只有14項產品獲證上市,只占總量的32.56%。相關企業需做好充分的準備工作,要保證申報產品已經完整定型才能順利獲批上市。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|