
|
|
|||||
|
||||||
2017藥品檢查報告:38家中藥企業遇飛檢21家被撤證!摘要:
醫藥網6月11日訊 6月8日,國家藥品監督管理局官網發布《2017年度藥品檢查報告》(簡稱《檢查報告》),對2017年國家開展的藥品注冊生產現場檢查、藥品GMP跟蹤檢查、藥品飛行檢查、進口藥品境外生產現場檢查、藥品流通檢查、國際藥品GMP觀察檢查等工作情況統計分析結果進行公布。
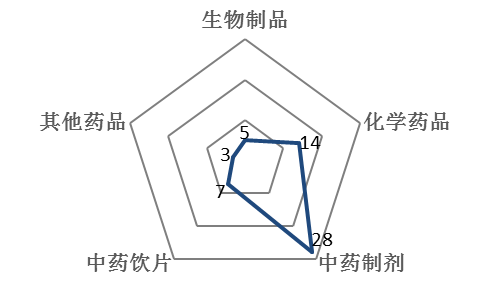
值得注意的是,在飛行檢查工作中,中藥企業暴露出的一系列質量體系問題仍十分突出。《檢查報告》披露,2017年原國家食品藥品監督管理總局共開展藥品GMP飛檢57家次,涉及吉林、四川、福建等21個省(市),包括5家生物制品生產企業(含血液制品)、14家普通化學藥品生產企業,以及38家中藥類生產企業(28家中藥制劑生產企業、7家中藥飲片生產企業、3家中藥提取物生產企業)。中藥類生產企業飛行檢查結果顯示,29家企業不符合相關要求,其中21家企業被收回藥品GMP證書;符合要求的共有7家企業;2家企業已無相關生產資質。
 藥品飛行檢查劑型分布情況
 藥品飛行檢查發現嚴重問題的品種分布情況
中藥企業檢查集中 占比達61%
飛檢永遠“正在路上”,且檢查力度遠大于前。質量源于設計(QbD),GMP要求企業從原料、人員、設施設備、生產過程、包裝運輸、質量控制等方面按照國家有關法規達到衛生質量要求,并形成一套可操作的作業規范。中藥類生產企業必須具備良好的生產設備,合理的生產過程,完善的質量管理和嚴格的檢測系統,確保最終產品符合法規監管要求。
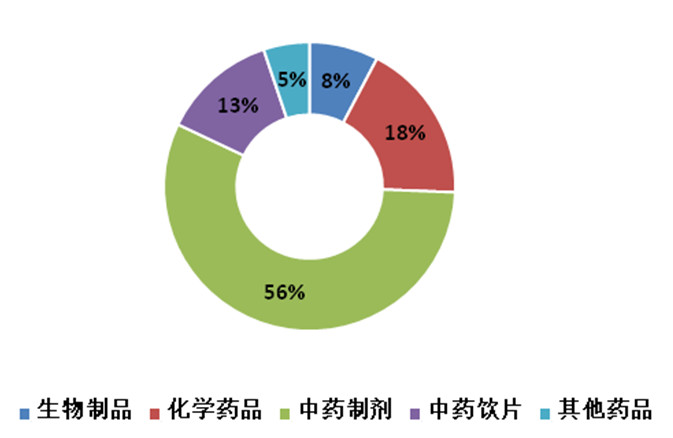
《檢查報告》指出,在57家次飛行檢查中,占比最高的是中藥制劑生產企業,占全部飛行檢查工作的49%,中藥飲片占比約12%,普通化學藥品占比約25%,生物制品占比約9%;全年飛行檢查發現存在問題的共有39家企業,占比約68%,其中有27家問題嚴重的企業要求省局收回GMP證書或立案查處。
由于中藥類生產企業的檢查較為集中,監管部門針對中藥制劑、中藥飲片、中藥提取物生產企業共派出30個檢查組129人次對38家企業進行了飛行檢查,其中全國評價性抽驗探索性研究發現問題的有16家企業,信訪舉報的有12家企業,針對檢查發現問題開展延伸檢查的有8家企業,經研判發現風險較高的企業2家。
中藥類企業發現的主要問題
中成藥生產企業
(1)不按處方標準投料。檢查發現該類違法違規的中成藥生產企業只要求最終產品能夠滿足法定的質量控制標準,不考慮藥品的安全性、有效性和患者的權益,主觀故意不按處方標準投料生產。
(2)違背法定制法,擅自改變工藝。2017年飛行檢查發現的該類問題集中體現在企業為了降低生產成本或使用不合格原藥材投料將處方中部分應提取的中藥材不按標準提取,而是粉碎后直接投料。
(3)為應對監督檢查,編造相關記錄文件。2017年的飛行檢查發現多家企業存在兩套甚至三套物料賬、物料出入庫記錄和生產批記錄的情況。
中藥飲片生產企業
2017年,對中藥飲片的飛行檢查主要針對外購中藥飲片直接進行分裝、銷售,購進中藥材或炮制后的產品不按標準進行檢驗,以及染色、增重等問題。檢查發現為應對監督檢查,一些企業存在編造批生產記錄和批檢驗記錄的行為。
(1)外購飲片直接分裝、銷售。
(2)未按照標準對購入或銷售的中藥材、中藥飲片進行全檢。不能提供對應藥材檢測設備使用登記記錄,缺少藥材檢驗用對照品、毛細管柱,無對應項目檢測能力,但仍出具全檢報告。
(3) 批生產記錄不真實。不能提供主要生產設備的使用日志,特定藥材批生產記錄顯示用量與領料單顯示用量相差5倍,部分生產用輔料批生產記錄用量前后不一致;批生產記錄中員工簽名不真實。
中藥提取物的生產備案
2017年選取了兩家低價銷售的藿香正氣水生產企業進行飛行檢查,同時延伸至三家甘草浸膏、廣藿香油的中藥提取物生產廠進行檢查。發現企業還是有不同形式的違反 《食品藥品監管總局關于加強中藥生產中提取和提取物監督管理的通知》(食藥監藥化監〔2014〕135號)的情況。
實際案例
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|