
|
|
|||||
|
||||||
雙黃連注射劑被令修訂說明書!企業再評價進度如何?摘要:
醫藥網6月12日訊 6月11日,國家藥監局發布公告,決定修訂雙黃連注射劑〔雙黃連注射液、注射用雙黃連(凍干)、雙黃連粉針劑〕說明書,要求增加警示語,并對【不良反應】、【禁忌】和【注意事項】項進行修訂。截至目前,今年已發布3則中藥注射劑說明書修訂公告(還有參麥注射液、柴胡注射液),這也是半個月內第2個被要求修訂說明書的中藥注射劑。
從2006年魚腥草注射液被叫停,到2009年雙黃連注射液致死事件,到2012年淘汰穿山龍注射液、柴辛感冒注射液等,中藥注射劑一直頗受爭議。《國家藥品不良反應監測年度報告(2017年)》顯示,2017年中藥不良反應/事件報告中,注射劑和口服制劑所占比例分別是54.6%和37.6%;從嚴重報告涉及的給藥途徑看,靜脈注射給藥占比較高。
中藥注射劑古往今來
數據顯示,1999-2006年,中藥注射劑年均增長率超30%,年銷售額超200億元;2008年銷量排名前10位的中成藥品種中,中藥注射劑獨占6種;米內網數據顯示,2016年中國城市公立醫院、縣級公立醫院、城市社區中心及鄉鎮衛生院(簡稱中國公立醫療機構)終端中藥注射劑的總規模超過1048億元。如此龐大的市場,卻僅得益于醫療費用的粗放式增長,中藥注射劑的千億規模產業,始終缺乏明確的安全性和有效性臨床數據支撐。
梳理近年來多地發布的輔助用藥重點監控目錄可以發現,基本上絕大多數受限的輔助用藥實際上都是中藥注射劑。最常見的如參附注射液、參麥注射液、紅花注射液、大株紅景天注射液等,都被多個地區重點監控。
而梳理上市藥企2017年財報,30個市場規模過億的中藥注射劑中,60%(18個)的產品2017年銷售額明顯下滑。金陵藥業的脈絡寧注射液跌幅最大,達51.47%,2017年銷售規模萎縮至2.31億元。究其原因,一方面是因為國內中藥注射劑生產企業普遍缺乏對臨床研究和臨床數據的積累,因此,很難證明其安全性和有效性;另一方面是我國此前對于中藥注射劑的上市審批并不嚴格。
再評價行動在路上
隨著中藥注射劑質量問題頻發,中藥注射劑安全性受到質疑,中藥注射劑的再評價工作迫切提到日程(見表1)。
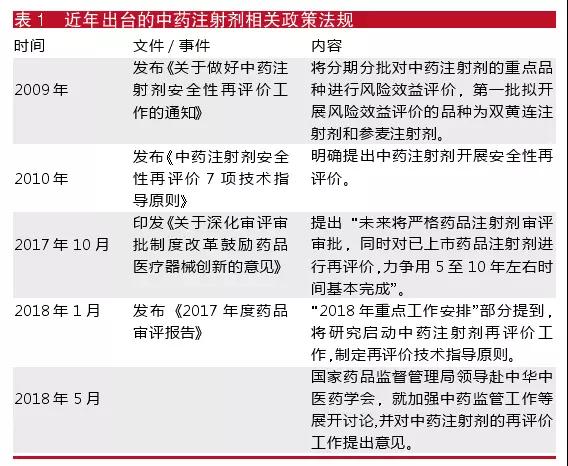 今年4月,中藥注射劑發展出現了里程碑事件,中國中藥協會成立中藥注射劑專委會,共同解決企業品種的研究和發展問題,推進和落實國家相關政策法規。
同樣,中藥注射劑再評價一直為業界所關注,許多企業也希望借助中藥注射劑再評價自證藥效(見表2)。如麗珠集團的參芪扶正注射液軟袋有望在2018年年底之前上市,且獲得了美國的臨床批件,并正繼續開展參芪在美國的臨床研究,同時也會不斷進行該品種在國內的上市后研究。
 |
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|