
|
|
|||||
|
||||||
一致性評價潮落后CRO行業將大洗牌?摘要:
醫藥網7月17日訊 自2015年藥品注冊改革啟動以來,伴隨著臨床試驗自查核查和仿制藥品一致性評價的陸續開展,CRO/研發技術機構迎來高速發展的契機。通過分析2017年化學藥和生物制品的CRO/研發技術機構的申報數據,可以側面了解注冊法規變革后CRO/研發技術機構的發展態勢。
三大實力評估:CRO能做多少事、多大事?
是否“全能CRO”?
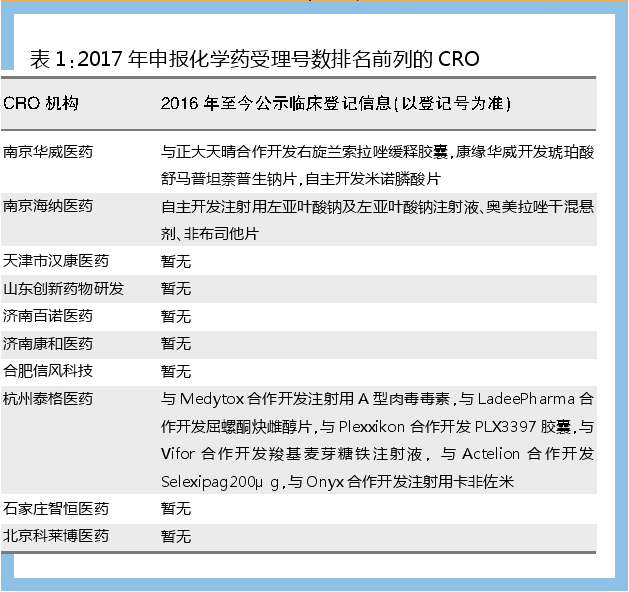
對2017年以來申報化學藥臨床受理號數排名前列的CRO機構進行分析可以發現,江蘇和山東排名前列的CRO機構數較多。若將上述CRO機構與其2016年以來的臨床登記信息比較可以發現,并不是所有CRO企業都能順應上市許可持有人和臨床自查核查政策而華麗轉身為“從藥學部分到生物等效性研究整個項目都能承接”的“全能CRO”。當然,這有可能是因為這些研發公司的臨床試驗/生物等效性研究是以其它公司名義登記的,或者目前所承接的項目暫未開展臨床試驗/生物等效性研究。
 臨床需求把控能力如何?
優先審評產品自2015年12月起公布第一批擬納入優先審評的產品名單。獲得優先審評也可以從側面反映CRO企業的臨床需求把控能力。CRO中獲批產品數最多的企業是杭州泰格醫藥,獲得優先審評的產品是Ataluren口服混懸液顆粒、Inebilizumab注射液、屈螺酮炔雌醇片和依庫珠單抗注射液,以上全是進口注冊。不統計原料藥,其余CRO/研發技術機構基本只有1個項目獲得優先審評。
能否成為上市許可持有人?
化學藥申報生產方面,2017年中山萬漢制藥和中山萬遠新藥研發的玻璃酸鈉滴眼液和聚乙烯醇滴眼液以新4類報產,浙江醫藥新昌制藥廠和太景醫藥研發(北京)的1類新藥蘋果酸奈諾沙星氯化鈉注射液報產。正大天晴藥業集團和南京愛德程寧欣藥物研發的1類新藥鹽酸安羅替尼膠囊已經獲批上市。暫無CRO/研發技術機構脫離生產廠家單獨申報生產,預計2018年藥品上市許可持有人試點結束以前,沒有CRO/研發技術機構能夠以2016年以后新獲批的能產業化生產的藥品為由成為藥品上市許可持有人。
生物藥研發熱:三類最熱門的項目
CAR-T 備受青睞
2017年之前,國內生物科技類公司獲批的產品以疫苗為主。但2017年以來,越來越多生物科技公司啟動治療用生物制品新藥申報,特別是視為可“趕超歐美”的創新藥申報,如PD-1/PD-L1、CAR-T療法。
除了國內制藥領先企業積極參與布局之外,生物科技類企業已然成為研發的主力軍,其中CAR-T類項目備受青睞。如表2所示,CAR-T療法目前已申報23個受理號,涉及16家企業,99%的申報企業都是生物醫藥科技公司。
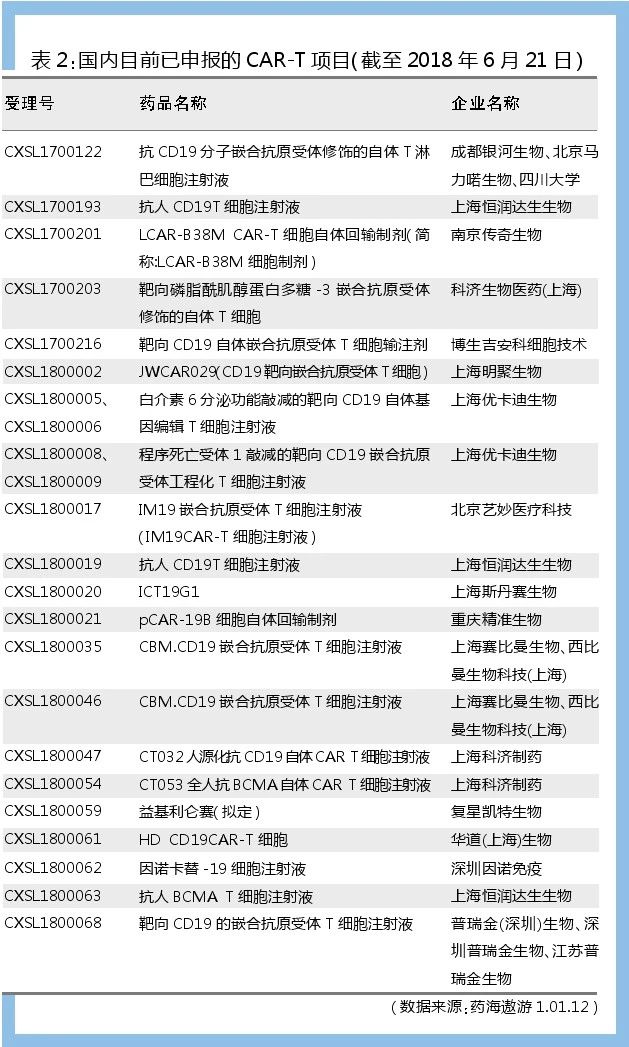 優先審評方面,共4個項目獲得優先審評,分別為:北京馬力喏生物的抗CD19分子嵌合抗原受體修飾的自體T淋巴細胞注射液、上海恒潤達生生物的抗人CD19 T細胞注射液、科濟生物醫藥(上海)的靶向磷脂酰肌醇蛋白多糖-3嵌合抗原受體修飾的自體T細胞、南京傳奇生物的LCAR-B38M CAR-T細胞自體回輸制劑CAR-T療法。目前僅南京傳奇生物的LCAR-B38M CAR-T細胞自體回輸制劑獲批臨床。但暫未在藥物臨床試驗登記公示平臺查詢到臨床項目啟動的信息。
單抗/多抗 積極布局
單克隆抗體或多克隆抗體也是生物科技公司在2017年積極布局的方向。如蘇州康寧杰瑞生物申報的注射用重組人源化抗HER2雙特異性抗體,以及上海博威生物和北京雙鷺藥業合作申報的重組全人抗CTLA-4單抗注射液,這兩個產品都已獲批臨床。
GLP-1 生物類似藥賽跑
降糖藥GLP-1也是熱點,其中上海銀諾醫藥和昆明銀諾醫藥申報的蘇帕魯肽注射液已獲批臨床。
值得關注的還有利拉魯肽注射液的研發趨熱,有三組生物科技公司團隊參與了生物類似藥競爭,分別為:重慶派金生物/重慶宸安生物,北京亦莊國際蛋白藥物技術/杭州先為達生物,連云港潤眾制藥/正大天晴藥業集團/上海醫藥工業研究院。利拉魯肽的仿制競爭對手還包括廣東東陽光藥業、通化東寶藥業和江蘇萬邦生化。
展望<<<
當一致性評價潮落,CRO將迎來并購潮
化學藥仿制藥業務(含已上市產品一致性評價)是國內大多數化學藥CRO/研發技術機構承接的業務。大多數CRO承接的項目都期望能夠獲得“一條龍”服務,因為國內不少生產企業沒有研發部門,于是期望一個項目交由一家CRO企業負責簽訂保底協議就可以安心當“甩手掌柜”。
然而,國內能夠將藥品研發項目各環節都了解透徹、僅僅從成本或者技術難度出發有選擇性地采取技術外包的生產企業并不多。不少企業甚至希望技術全外包模式反過來鍛煉內部研發團隊。從2017年注冊申報和臨床登記情況來看,申報受理號數排名前列的CRO研發機構并不是都能負責臨床項目。實際上,個別CRO企業的“一條龍”服務是將臨床研究私下再分包。一致性評價過后,CRO公司一旦沒有找到新的增長點,就要面臨強強整合,預計未來CRO的并購合并會越來越多。
另外,生物制品的研發科技公司的創新模式與美國的新藥研發模式比較相似,治療領域主要集中在抗腫瘤,熱點領域競爭也非常激烈。這些研發科技公司的主要目標,是在該產品目標細分治療領域獲得首家獲批上市。預計未來這類新藥模式的研發科技企業會越來越多,國內大企業若遇到青睞的產品,會對此類研發機構發起并購以獲得產品權利。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|