
|
|
|||||
|
||||||
249藥品說明書修改,還有一大批在路上摘要:
醫藥網7月30日訊
▍2017年至今249個藥品說明書修改,頻次呈加快趨勢
日前,國家藥監局發布了《國家藥品監督管理局關于修訂血塞通注射劑和血栓通注射劑說明書的公告(2018年第46號)》,這是自2017年以來第38次、2018年至今半年的第22次發布修改藥品說明書的公告,可見,藥品說明書的修改頻次在提高。
自2017年以來,共有38個批次249個藥品被修改,其中以化學藥為主,主要是由于2017年7月5日關于氟喹諾酮類的藥品說明書修改涉132個藥品。
其中化學藥20個批次179個藥品;中成藥17批次69個藥品;生物制品1個批次1個藥品。
但單從2018年來看,卻以中成藥為主。共計發布了23個批次75個藥品,其中中成藥12個批次54個藥品,化學藥10個批次20個藥品。可見,在未來藥品說明書的修改的重點對象將可能會是中成藥尤其是一些用量大、適應癥廣而禁忌、不良反應“尚不明確”或“尚無”的產品。
2017年1月至今藥品說明書修訂公告及涉及藥品品種情況如下表:
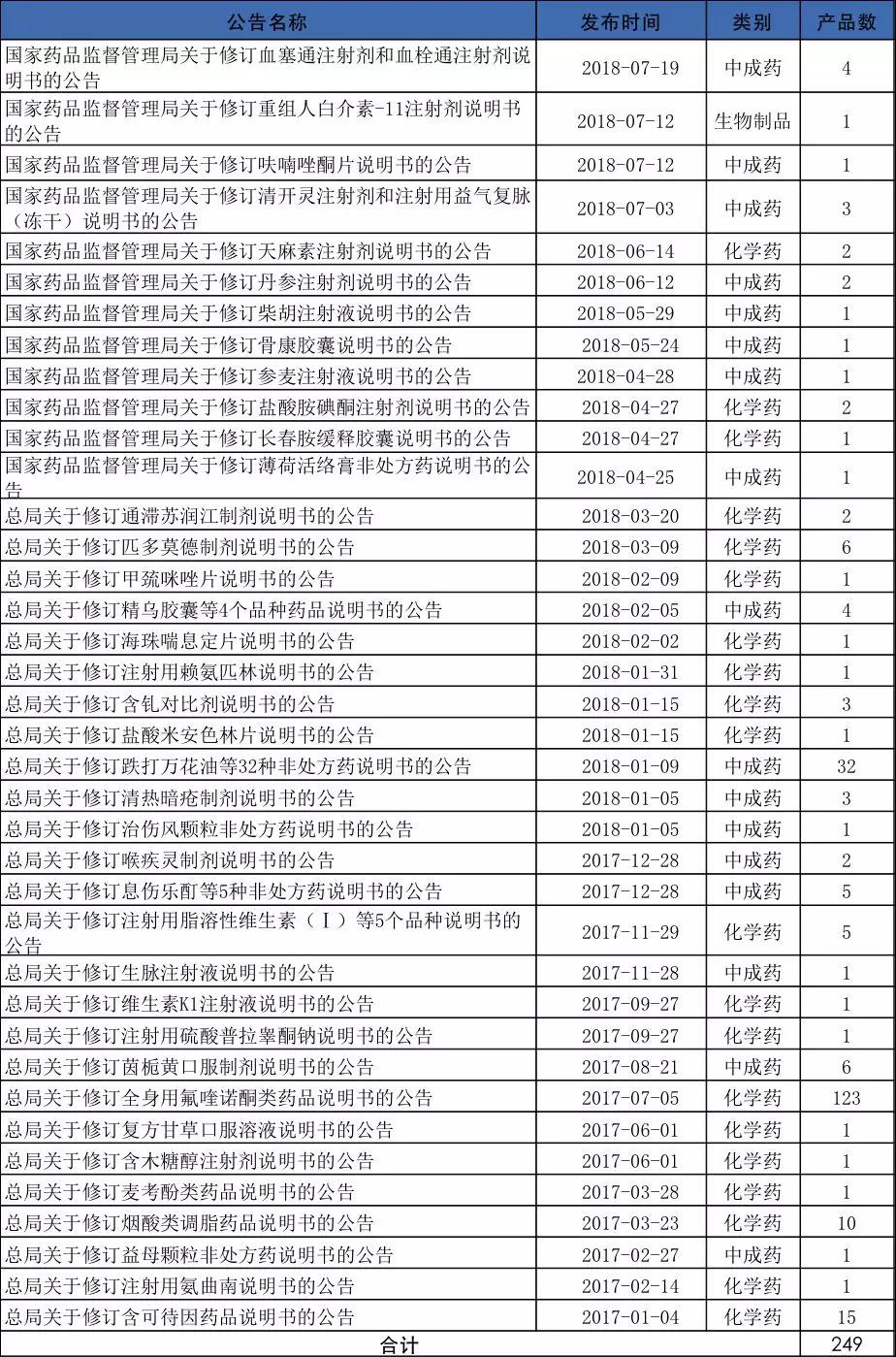 注:根據國家藥監局公告整理,供參考。
有一些藥品說明書的修訂會極大的減少用藥人群,這些會對制藥企業的銷售帶來影響,如柴胡注射液,在之前的臨床實踐中也有較大部分用于兒童,但在修改藥品說明書后明確不可用于兒童,則會受到較大影響。還有一些藥品,如血塞通注射液等品種增加禁忌為兒童禁用,因為這類藥品在臨床基本不用于兒童,所以影響相對較小。
▍藥品說明書修改兩大主要原因大揭秘
中成藥藥品說明書主要包含藥品成份、性狀、用法用量、禁忌、注意事項、物相互作用等;化學藥藥品說明主要包含安全性、有效性的重要科學數據、結論和信息,用以指導安全、合理使用藥品。所有藥品說明書應當充分包含藥品不良反應信息,要詳細注明藥品不良反應。
藥品不良反應網絡監測完善,還歷史遺留舊賬
隨著國家用藥監測網絡的完善,藥品不良反應反饋系統不斷完善。我國藥品注冊中原來很多地標升國標的藥品在轉化評價過程中,很多藥品的質量安全性與再評價工作都滯后或缺失,導致了目前上市銷售的很多藥品說明上的【禁忌】、【不良反應】項目為“尚不明確”,尤其是中成藥,絕大多數藥品在這兩欄基本都是“尚不明確”。國家藥品監督管理部門正在發力解決國家藥品評審過程中歷史性的遺留欠賬問題,不斷完善藥品說明書。
監控藥品用藥風險,提升用藥安全
2017年國家藥品不良反應年度報告顯示,通過藥品說明書修訂、《藥品不良反應信息通報》、《藥物警戒快訊》等公告顯示,國家局通過日監測、周匯總、季度分析等工作機制對國家藥品不良反應監測數據進行分析評價,深入挖掘藥品風險信號,并采取相應風險管理措施。
兒童用藥警示
目前由于兒童用藥比較缺乏,很多藥品均是兒童減半使用。但是國家藥監局從兒童用藥安全考慮,明確增加多個藥品的“兒童禁用”要求。
此外,還可能是藥品上市前臨床研究過程中,受到許多客觀因素限制,例如病例少、研究時間短、試驗對象年齡范圍窄、用藥條件控制較嚴等,因此,藥品在不良反應發現上存在缺陷和不足,因此隨著藥品用藥人數的增加會不斷完善。
▍還有大批藥品在修改的路上
根據今年藥品說明書修改的趨勢來看,重點在中藥注射劑,且修改的重點針對內容是針對藥物相互作用、禁忌“尚不明確”或“尚無”,且大多是針對中藥注射劑。
筆者通過檢索市場銷售規模較大的一些注射劑品種說明書發現多個中藥注射劑的藥品說明書在藥物相互作用或禁忌一欄為“尚無相關信息”或“尚不明確”,大多數中藥注射劑的不良反應也為“尚不明確”。根據國家藥品監管趨勢,這些品種將成為重點,也是藥品說明書未來修訂的重點對象。
一些重點可能要修訂說明書的品種如下表:
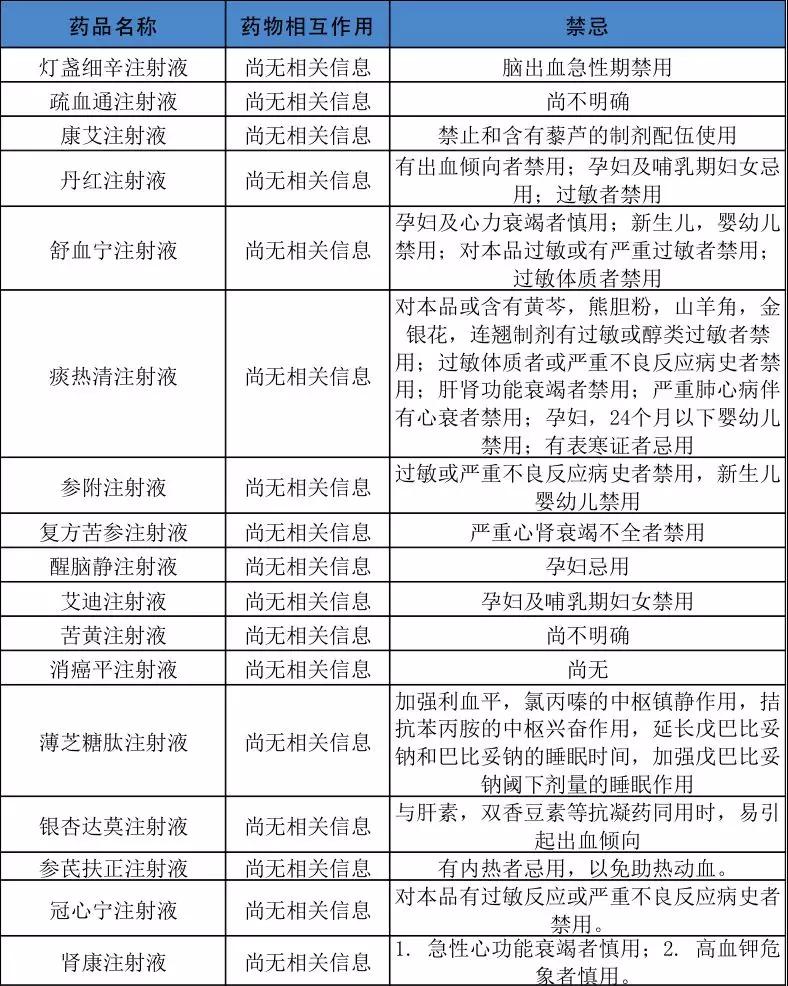 注:根據公開資料整理,供參考。
當然,也不排除由于其他藥品由于在上市后副作用監控統計有了新的發現,或者提示新的使用風險、警示等,也會導致藥品說明書的修改。但是根據這一年多來的趨勢發現,上述表中類似的品種將大概率要修改說明書。
▍制藥企業該如何應對?
藥品獲批上市銷售只是一個新的起點,制藥企業需要在后續的臨床使用中不斷發現藥品存在的問題,不斷完善和提升藥品質量和療效,規范藥品的臨床使用。
要應對藥品說明書的修改,制藥企業主要應該從以下幾方面努力:
一是確保藥品研發過程的規范性、科學性、嚴謹性。
只有在藥品研發過程中確保每一個階段、每一個流程的規范、科學和嚴謹,才能保證藥品的各項指標不存在問題,才能在藥品說明書中的每一欄都有據可查。只有在研發過程中的每一步做到規范、科學嚴謹才能保證藥品說明書的編寫符合國家藥品說明書的編寫原則和要求,保證說明書的嚴謹;也只有這樣才能避免在藥品獲批上市后降低出現紕漏的可能,避免說明書被修訂。
二是切實、積極大力推進藥品再評價工作。
根據藥學的最新學術水平,從藥理學、藥劑學、臨床醫學、藥物流行病學、藥物經濟學及藥物政策等主要方面,對已正式批準上市的藥品在社會人群中的療效(有效性)、不良反應(安全性)、用藥方案、穩定性及經濟學等是否符合安全、有效、經濟的合理用藥原則作出科學的評議和估計。而不是一些中藥注射劑做的所謂的安全性再評價只是營銷性質的評價,缺少具有說服力的臨床追蹤數據。
三是積極做出主動修改說明書的準備。
藥品生產企業根據藥品上市后的安全性、有效性情況記錄及時修改說明書,不斷完善藥品全生命周期的質量管理。對已確認有重大質量風險的,制藥企業應及時按照監管部門的要求,及時修訂說明書并向醫療使用單位發出風險警示,要求用前嚴格檢查,防止不合格或者缺陷藥品用于臨床治療。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|