
|
|
|||||
|
||||||
優先審評哪些產品最熱?461個優先審評產品剖析摘要:
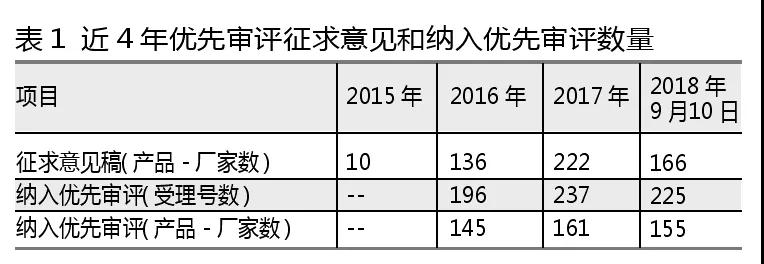
醫藥網10月10日訊 自2015年12月21日公布《實行優先審評審批的兒童用藥注冊申請名單(第一批)》征求意見稿以來至今,咸達藥海遨游數據發現共有534個產品-廠家進入擬納入優先審評征求意見名單。
而自CDE在2016年2月首次公示納入優先審評產品清單以來,截至2018年9月10日,共有658個受理號數納入優先審評名單,對應461個產品-廠家。
筆者對近4年納入優先審評的461個產品-廠家進行分析發現,有129個產品-廠家的申報理由為“具有明顯治療優勢”,是8種申報理由中產品數量最多的理由。
 納入名單的理由如何變化?
2015年“兒童藥”→2016年“臨床必需”“首仿”→2017年至今“治療優勢”
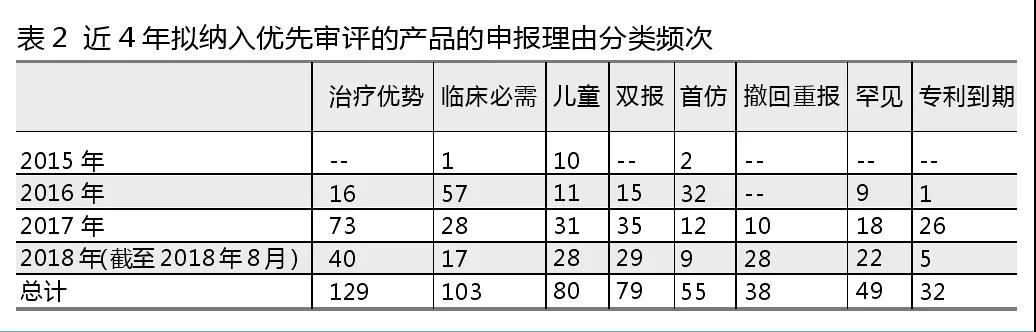
優先審評的申報理由有治療優勢、臨床必需、兒童藥、雙報、首仿藥、罕見病、撤回重報、專利到期8種。
咸達藥海遨游數據對擬納入優先審評產品對應的申報理由分類進行分析,如表2所示。與“現有治療手段相比具有明顯治療優勢”的理由對應的產品-廠家數最多,其中2017年以此理由申報的產品-廠家數最多。“臨床必需”(不含兒童用藥和罕見藥)排名第二,2016年以此理由申報的產品-廠家數最多。“兒童用藥”和“雙報”理由納入優先審評的產品廠家數相當,并且都是2017年申報的產品-廠家數暫時是歷年最多的。
從年限來看,2015年進入擬納入優先審批的理由主要是“兒童用藥”,2016年則是以“臨床必需”和“首仿”為主,2017年至今則更看重“治療優勢”。由此可見,替代現有療法的藥物作為優先審評的申報理由成為新趨勢。
 “治療優勢”產品為何最熱?
★獲批幾率高,獲批率超過50%
★進口藥多,八成為進口藥申報
★“以含中國數據的國際多中心試驗結果申請免臨床”
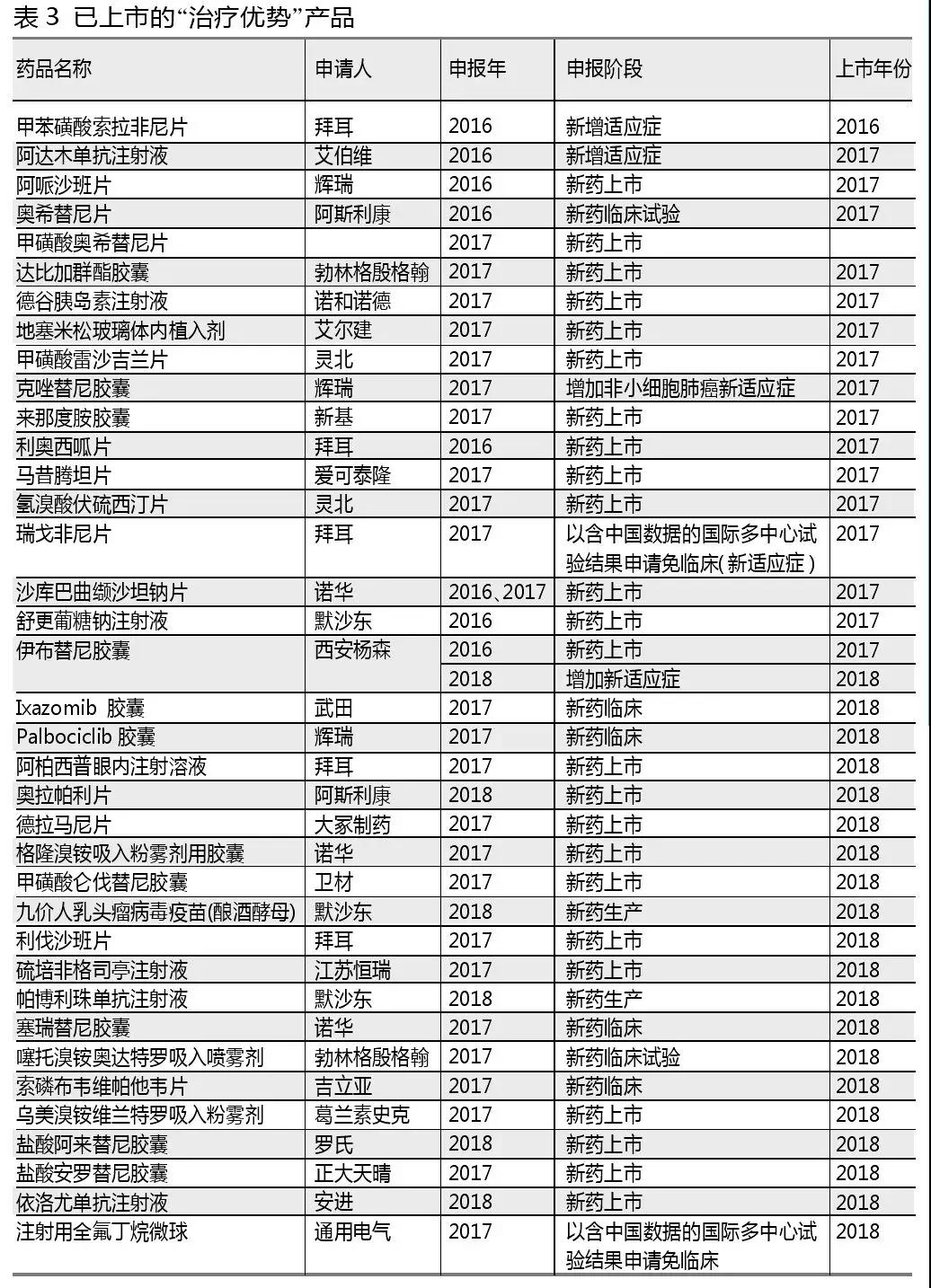
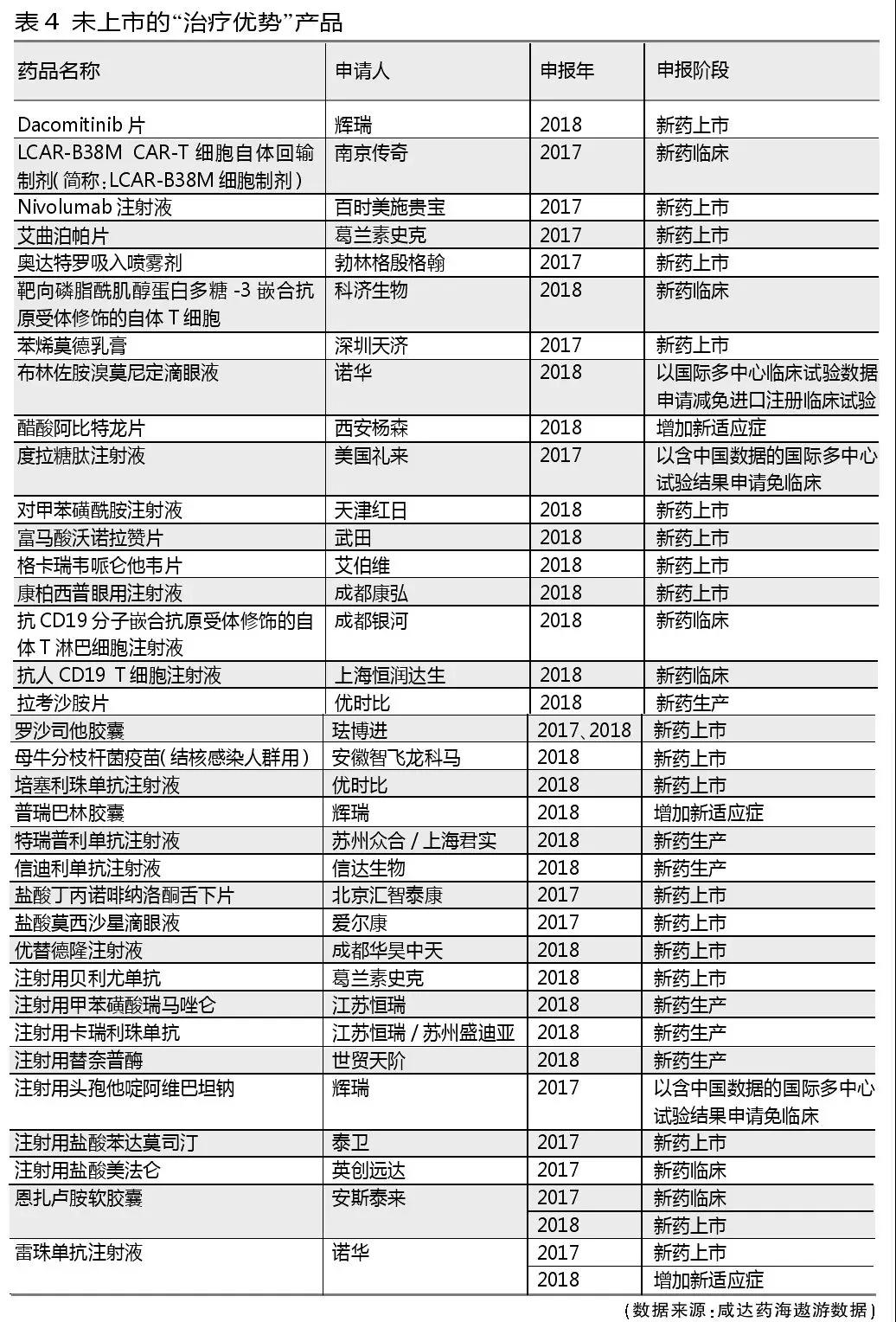
帶有“具有明顯治療優勢”類似字眼的申報理由都被列為“治療優勢”類別藥品。此類藥品獲批的幾率較高,71個產品中有37個已批準上市或獲批增加適應癥。
129個“與現有治療手段相比具有明顯治療優勢”的藥品-廠家中,104個屬于進口注冊。拜耳是獲批產品最多的進口藥企,2016年甲苯磺酸索拉非尼片新增適應癥,2017年利奧西呱片新藥上市,瑞戈非尼片以含中國數據的國際多中心試驗結果申請免臨床增加新適應癥,2018年阿柏西普眼內注射溶液新藥上市,利伐沙班片預計是增加新適應癥。
中國國內企業中,恒瑞醫藥(包含江蘇恒瑞、上海恒瑞、江蘇盛迪、蘇州盛迪亞)當之無愧為申報藥品數量最多的企業,申報了硫培非格司亭注射液、注射用甲苯磺酸瑞馬唑侖和注射用卡瑞利珠單抗。其中硫培非格司亭注射液2018年上市。
值得注意的是,2017年起已有“以含中國數據的國際多中心試驗結果申請免臨床(新適應癥)”的申報階段,對應布林佐胺溴莫尼定滴眼液、度拉糖肽注射液、磷丙替諾福韋片、瑞戈非尼片、注射用全氟丁烷微球和注射用頭孢他啶阿維巴坦鈉6個產品。這6個產品除了磷丙替諾福韋片的申報理由是“病毒性肝炎”被歸納入“臨床必需”分類之外,其余5個產品都屬于“治療優勢”產品。瑞戈非尼片和注射用全氟丁烷微球分別在2017年和2018年獲批。
武田的枸櫞酸伊沙佐米膠囊(Ixazomib膠囊)、輝瑞的哌柏西利膠囊(Palbociclib膠囊)和吉立亞索磷布韋維帕他韋片沒有申報生產只申報臨床就獲批生產了。這也將會是未來加快審評的新趨勢。
  結語
創新一般有兩條路徑,一是適應癥沒有療法,需要發現新的療法。另一種是替代現有療法,比現有療法更有臨床優勢。
近兩年治療優勢的分類藥品申報較多且獲批較多,更多是出于市場的考慮,畢竟一個療法相對空白的適應癥,要讓醫生認識還要做醫生教育。
但是,替代現有療法的藥品“可遇不可及”,近兩年爆發更多是緣于2015年722臨床自查核查啟動以來的嚴格審批,以及近兩年對有中國臨床數據的國際多中心數據的新藥的加速上市。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|