
|
|
|||||
|
||||||
齊魯、正大天晴等搶首仿!揭密醫保談判品種仿制熱度摘要:
醫藥網11月9日訊 人力資源社會保障部在2017年7月13日發布的關于將36種藥品納入國家基本醫療保險、工傷保險和生育保險藥品目錄乙類范圍的通知中,共有31個西藥、5個中藥進入目錄。
時隔一年,31個西藥的仿制局面發生了什么改變?
細數仿制扎堆傾向品種
咸達數據V3.5以注冊申報數據作為判斷醫保談判成功后仿制廠家增加的標志。分析發現,利拉魯肽、替格瑞洛和硼替佐米是醫保談判成功后新增仿制廠家較多的產品,阿比特龍首仿之爭激烈。
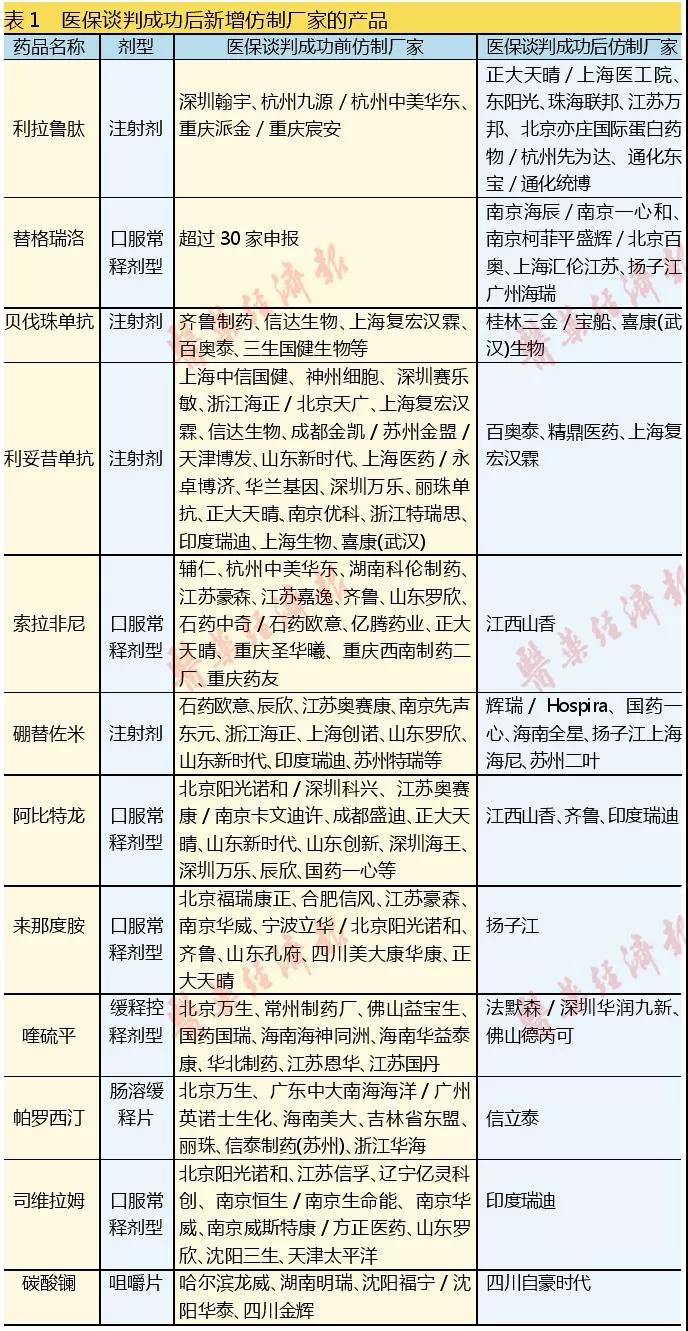 糖尿病用藥胰高血糖素樣肽-1(GLP-1)類似物利拉魯肽,除了深圳翰宇是以化學藥申報的,其余生產廠家都是以治療用生物制品申報的。目前僅深圳翰宇、杭州九源/杭州中美華東、通化東寶/通化統博獲批臨床,但僅杭州九源進行臨床備案。
抗血栓形成藥的血小板凝聚抑制劑替格瑞洛片在醫保談判成功前已有30多家仿制,2017年醫保獲批后信立泰挑戰專利并于2018年第一季度挑戰成功,2018年替格瑞洛成為最多廠家申報生產的產品。新注冊法改革后,BE備案到申報生產最快也要6個月,國內企業的動向數據在2018年才能有所體現。醫保談判成功前按舊6類申報的廠家在2018年基本都改成按新4類申報,如北京四環、廣東東陽光、江蘇萬邦、正大天晴和浙江海正。2018年替格瑞洛片的首仿落在信立泰。
蛋白酶體抑制劑硼替佐米2017年首仿獲批,現已有3家企業仿制上市,分別是正大天晴、齊魯和首仿廠家豪森。2018年也是仿制的競爭熱點,除了新增仿制的輝瑞/ Hospira、國藥一心、海南全星、揚子江上海海尼、蘇州二葉,還有石藥歐意以新4類申報。值得注意的是輝瑞/ Hospira以5.2類申報進口仿制藥。
前列腺癌內分泌治療用藥阿比特龍首仿之爭已開始,目前上市申報的廠家除了醫保談判成功后的江西山香、齊魯、印度瑞迪,還有此前以3.1申報的正大天晴。
仿制“無人區”四大特征
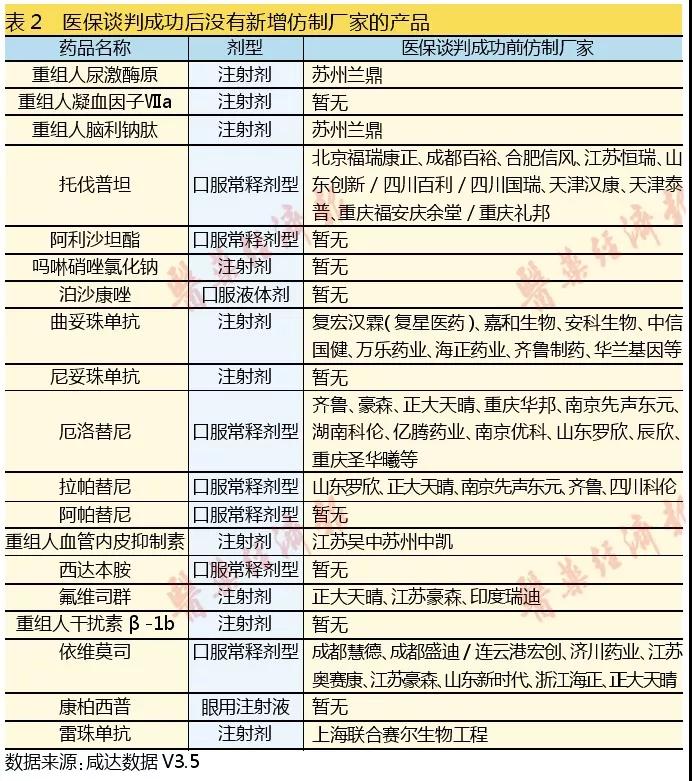 進入醫保后基本沒有新增仿制廠家的產品可能是以下四個原因:
其一,原研廠家是國產廠家。如天士力的抗血栓形成藥重組人尿激酶、成都諾迪康的重組人腦利鈉肽、上海艾力斯/信立泰血管緊張素Ⅱ拮抗劑阿利沙坦酯、江蘇豪森的全身用抗菌藥嗎啉硝唑氯化鈉、百泰生物的尼妥珠單抗、江蘇恒瑞的蛋白激酶抑制劑阿帕替尼、山東先聲的重組人血管內皮抑素注射液、深圳微芯的西達本胺、成都康弘的康柏西普。
二是罕見病藥或適應癥比較窄的藥品。如抗出血藥重組人凝血因子Ⅶa、利尿劑治療多囊腎的托伐普坦、拜耳治療多發性硬化的重組人干擾素β-1b。
三是仍在專利保護期的藥品。如全身用抗真菌藥泊沙康唑口服混懸液、葛蘭素史克的甲苯磺酸拉帕替尼片、阿斯利康的氟維司群、北京諾華的依維莫司、新基的來那度胺、諾華的雷珠單抗。對于新基的來那度胺,2017年雙鷺藥業以挑戰專利成功得以獲批上市,2018年以新4類申報的僅揚子江和齊魯。
四是競爭激烈且臨床試驗耗時較長的熱門藥,比如曲妥珠單抗。
值得注意的是,對于曲妥珠單抗,三生國健藥業2016年撤回后重新遞交注射用重組抗HER2人源化單克隆抗體(賽普汀)的上市申請。
2018年也是單抗生物類似物報產的啟動年,2018年8月齊魯搶先申報貝伐珠單抗的生物類似物上市(新藥2類)。上海復宏漢霖申報利妥昔單抗的生物類似物上市(新藥2類),上海中信國健曾報產但自查核查已撤回。
2016年大量生產廠家獲批臨床的口服固體仿制藥也屬于此類。如厄洛替尼,上海創諾2017年2月以舊6類申報生產后,2018年申報的基本都是新4類且醫保談判前就開始研究的廠家,如南京優科/南京力博維、江蘇豪森和蘇州特瑞。甲苯磺酸索拉非尼2018年以新4類報產的有重慶藥友和江西山香,后者2018年3月BE研究備案信息公開,8月申報注冊。
小結<<<
未來,通過醫保談判進入醫保目錄、動態調整醫保目錄將會成為常態,這意味著國內新上市的藥品非常有希望在上市一年內獲批進入醫保。這類產品如果有專利門檻,將會降低仿制熱度。首仿藥獲批上市和進入醫保目錄將會刺激國內生產廠家加快申報的意愿。此外,對于我國國內廠家上市的新藥,國內廠家仿制的意愿并不是太大,與這些產品仍在專利期也有一定的關系。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|