
|
|
|||||
|
||||||
普利制藥注射劑出口再添新兵 依替巴肽美國獲批摘要:
醫藥網1月30日訊 1月28日,普利制藥發布公告稱,近日收到美國食品藥品監督管理局簽發的依替巴肽注射液ANDA的批準通知,依替巴肽注射液獲FDA 批準上市。依替巴肽原研尚未在國內上市,國內企業豪森和翰宇藥業擁有生產批文,普利制藥的依替巴肽注射液或將通過“國外轉報國內”方式遞交上市申請,有望在 2019 年獲批國內上市。
藥品基本情況
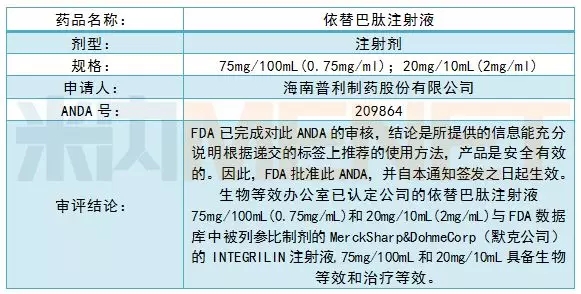 依替巴肽是血小板糖蛋白Ⅱb/Ⅲa受體拮抗劑,通過選擇性、可逆性抑制血小板聚集的最終共同通路,可逆轉因血栓形成而導致的缺血狀態。該產品用于急性冠狀動脈綜合癥患者的治療。
依替巴肽注射液由COR Therapeutics,Inc.最初研發,于1998年5月在美獲準上市,由默克公司負責銷售;1999年7月在歐洲獲準上市,由葛蘭素史克公司負責銷售,商品名均為INTEGRILIN,目前已在全球廣泛上市銷售。
普利制藥的依替巴肽注射液成功研發后進行了多國注冊申報,已于2018年2月獲得了荷蘭上市許可,于2018年7月獲得了德國上市許可,并于近日收到美國FDA的批準通知,表明其質量和療效與原研產品一致,標志著普利制藥具備了在美國銷售依替巴肽注射液的資格,將對公司拓展美國市場帶來積極影響。
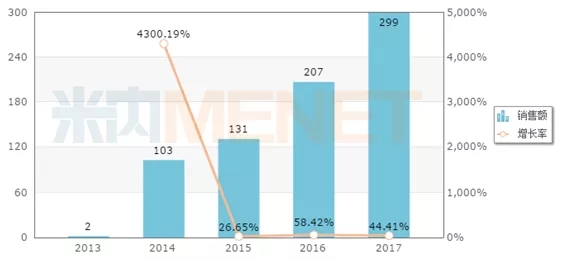
據米內網數據,依替巴肽國內市場尚小,2017年在中國公立醫療機構終端銷售額為299萬元。該產品原研尚未在國內上市,國內企業豪森和翰宇藥業擁有生產批文。普利制藥的依替巴肽注射液或將通過“國外轉報國內”方式遞交上市申請,有望在 2019 年獲批國內上市。
中國公立醫療機構終端依替巴肽銷售情況(單位:萬元)
 |
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|