
|
|
|||||
|
||||||
化學仿制藥參比制劑遴選與確定程序發布!摘要:
醫藥網3月29日訊 3月28日,國家藥品監督管理局官網掛出《關于發布化學仿制藥參比制劑遴選與確定程序的公告》,要求該公告自發布之日起實施,原國家食品藥品監督管理總局于2016年5月發布的《關于發布仿制藥質量和療效一致性評價參比制劑備案與推薦程序的公告》(2016年第99號)同時廢止,原發布的參比制劑相關文件與該公告不一致的,以該公告為準。
化學仿制藥參比制劑遴選與確定程序
為規范仿制藥審評和一致性評價工作,優化工作程序,強化服務指導,保證公平、公正、公開,現明確化學仿制藥參比制劑遴選與確定程序如下。
一、遴選原則
參比制劑遴選應以為公眾提供高質量的仿制藥品為目標,按如下順序選擇:
(一)原研藥品選擇順序依次為:國內上市的原研藥品、經審核確定的國外原研企業在中國境內生產或經技術轉移生產的藥品、未進口原研藥品。
原研藥品是指境內外首個獲準上市,且具有完整和充分的安全性、有效性數據作為上市依據的藥品。
(二)在原研藥品停止生產或因質量等原因所致原研藥品不適合作為參比制劑的情況下,可選擇在美國、日本或歐盟等管理規范的國家獲準上市的國際公認的同種藥品、經審核確定的在中國境內生產或經技術轉移生產的國際公認的同種藥品。
國際公認的同種藥物是指在美國、日本或歐盟等獲準上市并獲得參比制劑地位的仿制藥。
(三)其他經國家藥品監督管理局評估確定具有安全性、有效性和質量可控性的藥品。
參比制劑遴選路徑與確定程序流程圖
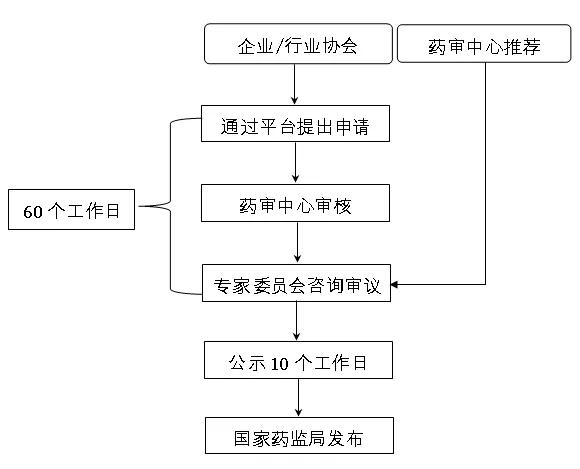 二、遴選路徑
(一)企業及行業協會申請
藥品生產及研發企業或行業協會應按照上述原則,通過參比制劑遴選申請平臺向國家藥監局藥品審評中心(以下簡稱藥審中心)提出申請,藥審中心在60個工作日內予以答復。
企業及行業協會應按要求參照《參比制劑遴選申請表》和《參比制劑遴選申請資料目錄》向藥審中心提交申請資料。參比制劑遴選申請平臺網址:https://wbca.cde.org.cn/wbca/。
(二)藥審中心推薦
藥審中心可基于藥品注冊資料及相關信息推薦參比制劑。
三、確定程序
(一)審核與審議
藥審中心對企業及行業協會提交的申請資料進行審核,并形成初步審核意見,提交專家委員會審議。
(二)公示與發布
藥審中心將對外公示審議結果,公示期為10個工作日,公示后,報國家藥品監督管理局發布,對有異議的品種,按照參比制劑存疑處理方式處理。
(三)參比制劑存疑處理方式
企業對公示或已發布的參比制劑有異議的,可向藥審中心提出異議和建議。藥審中心將對企業提交論證資料進行審核,并進行分類處理。
1.對既往經專家委員會論證或現行法規、政策等可解決的異議,藥審中心經審議后在45個工作日內予以答復。
2.上述之外的異議,藥審中心參照遴選程序組織召開專家委員會審議,在60個工作日內予以答復,原則上同一問題專家委員會論證不超過2次。
(四)溝通交流機制
企業在參比制劑遴選與確定過程中遇到重大技術問題的,可按照《藥物研發與技術審評溝通交流管理辦法》的有關規定,與藥審中心進行溝通交流。
四、其他要求
1.申請自證作為參比制劑的藥品生產企業應保障參比制劑的質量與可及性。
2.企業和協會應保證申請資料的真實性和完整性。
3.如經核實存在提供虛假信息、參比制劑停止供應或存在質量問題等情況,將撤銷該藥品參比制劑資格。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|