
|
|
|||||
|
||||||
第二批30個臨床急需境外新藥 輝瑞、BMS、賽諾菲產品在列摘要:
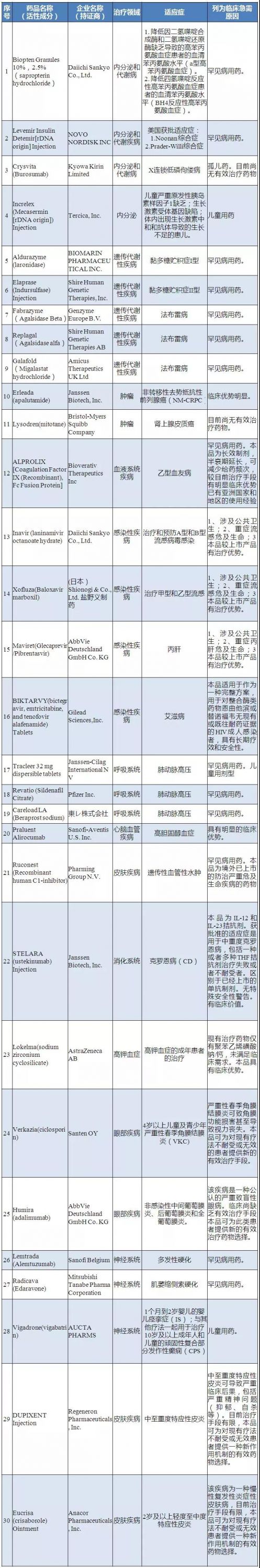
醫藥網3月29日訊 3月28日,國家藥品監督管理局藥品審評中心(CDE)官網對第二批臨床急需境外新藥進行公示,公示期限為3月29日~4月4日(5個工作日),名單上共有30個臨床急需境外新藥。
境外已上市臨床急需新藥名單,主要是近年來美國、歐盟或日本批準上市我國尚未上市的,用于罕見病治療的新藥,以及用于防治嚴重危及生命或嚴重影響生活質量的疾病,且尚無有效治療手段或具有明顯臨床優勢的新藥。
此次公示的30個品種中,大多都是罕見病、臨床急需的特效藥,其中包括百時美施貴寶的治療腎上腺皮質癌的Lysodren,輝瑞治療肺動脈高壓的Revatio、賽諾菲治療多發性硬化的Lemtrada等。
第二批臨床急需境外新藥公示名單
 按照《臨床急需境外新藥審評審批工作程序》,列入臨床急需境外新藥名單的品種,企業可提交相關資料后,直接提出上市申請。CDE建立專門通道開展審評,對罕見病治療藥品,在受理后3個月內完成技術審評;對其他境外新藥,在受理后6個月內完成技術審評。尚未申報的品種,可隨時提出與CDE進行溝通交流,盡快提出上市申請。
去年發布的首批48個臨床急需境外新藥名單中,已有包括非小細胞肺癌治療藥鹽酸阿來替尼、晚期乳腺癌治療藥物哌柏西利膠囊等11個品種批準上市。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|