
|
|
|||||
|
||||||
全球“藥王”危機?海正、復星、步長搶市場摘要:
醫藥網4月1日訊 2018年全年艾伯維藥品總收入327.53億美元,修美樂(阿達木單抗)這張王牌創下199.36億美元的成績,為公司貢獻超過60%的銷售收入。至今修美樂已有7年穩坐全球“藥王”寶座,亮眼的成績引來海正藥業、復星醫藥、步長制藥、華蘭生物等4家上市企業的垂涎,目前已有4家企業申請國內上市修美樂類似藥,替代品種諾華的司庫奇尤單抗也即將在國內上市。
“藥王”修美樂連續7年稱霸全球
2018年全年艾伯維藥品總收入327.53億美元,修美樂(阿達木單抗)這張王牌創下199.36億美元的成績,為公司貢獻超過60%的銷售收入。盡管沒能邁過200億美元的關口,但毫無疑問的是,修美樂未來幾年還將繼續稱霸全球“藥王”寶座。
艾伯維研發的修美樂(阿達木單抗注射液)是全球首個獲批的全人源抗腫瘤壞死因子(TNF-α)單抗,主要用于治療類風濕關節炎、強直性脊柱炎和銀屑病等自身免疫性疾病,2002年在美國獲批上市后銷售額快速上升,并在2012年以92.65億美元的銷售額奪得全球藥品冠軍,至2018年已是連續第7年稱霸全球。
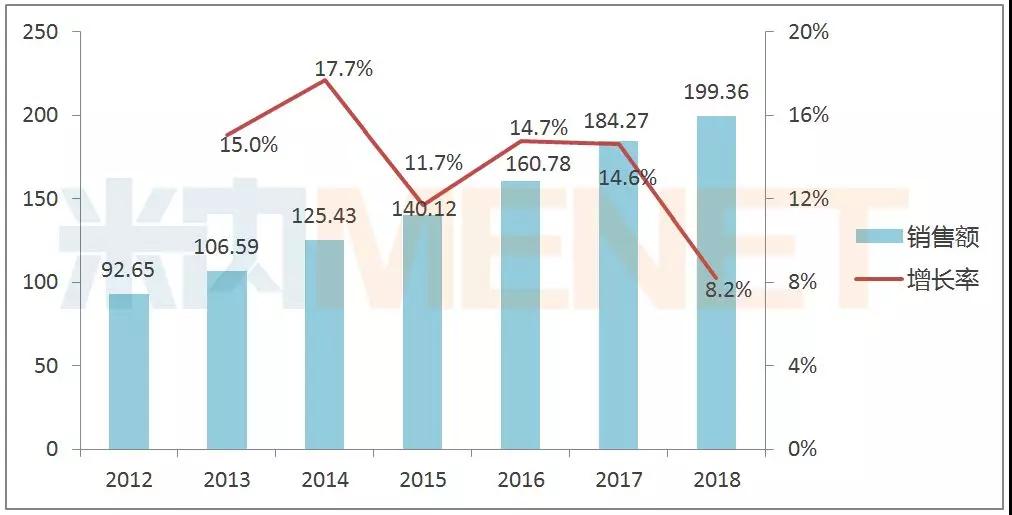 修美樂全球銷售情況(單位:億美元)
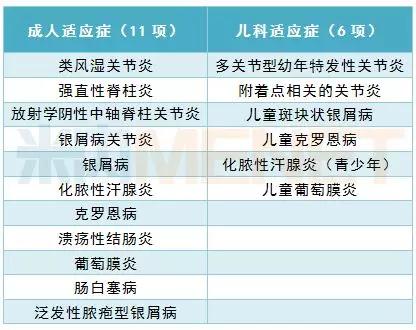
無敵的成績得益于艾伯維為修美樂布局的廣泛適應癥及強大專利壁壘。除了核心化合物專利,修美樂申請了50多項工藝與制劑專利。目前修美樂在全球獲批的適應癥多達17項,已在全球98個國家和地區銷售。
修美樂全球獲批適應癥
 2016年12月31日,修美樂核心化合物專利在美國到期,艾伯維通過專利保護將生物類似藥在美國的上市時間推遲至2023年;2018年10月16日,修美樂在歐洲的化合物專利到期,目前歐洲市場已有多款生物類似藥上市。受歐洲市場影響,修美樂銷售增長率由2017年的14.6%下滑至2018年的8.2%,修美樂也將在該市場進行降價。而暫未受影響的美國主要市場,將助力修美樂繼續穩坐全球“藥王”寶座。據艾伯維財報,2018年修美樂美國市場的銷售收入為136.85億美元,占修美樂全球銷售收入的68.6%。
四大企業爭上市,首個類似藥花落誰家?
據米內網數據,2017年中國公立醫療機構終端修美樂的銷售額為8125萬元,上市多年來一直銷量平平。盡管修美樂在全球暢銷多年,但在中國市場顯然還沒能大展身手,價格高與適應癥少或是修美樂在中國銷量不佳的原因。
自2010年在國內上市至今,修美樂僅獲批了3個適應癥:類風濕關節炎、強直性脊柱炎、成年中重度慢性斑塊狀銀屑病。艾伯維正爭取早日在國內獲批修美樂的克羅恩、虹膜炎適應癥。據米內網藥品招投標數據,2018年修美樂單支價格主要為7600元,按兩周一劑的用量來計算,患者每年用藥費用高昂。據艾伯維方面信息,修美樂已納入甘肅、青島、深圳、克拉瑪依、成都等地的大病醫保項目。如能進入2019年國家醫保目錄,修美樂國內銷量有望迎來轉折。
慘淡的銷量也沒能阻止國內前仆后繼的阿達木單抗生物類似藥研發者,目前研發該產品的國內企業有近30家,海正藥業、復星醫藥、步長制藥、華蘭生物等上市藥企也看好該市場,正在緊鑼密鼓地推進修美樂類似藥的研發。其中,百奧泰、海正藥業、信達生物、復星醫藥(復宏漢霖)提交的阿達木單抗注射液上市申請已獲CDE受理。
阿達木單抗國內申報上市情況
 在報產的4家企業中,百奧泰、海正藥業、信達生物的阿達木單抗注射液已被CDE納為優先審評品種。百奧泰是首個遞交阿達木單抗生物類似藥上市申請的國內企業,也是該產品首個獲優先審評的企業。若進展順利的話,百奧泰有望在2019年收獲首個國產阿達木單抗。
后援未至,“敵軍”蘇金單抗已兵臨城下
國內替代品種多也是修美樂銷量慘淡的因素之一,在修美樂之前,FDA已經批準了英夫利西單抗和注射用依那西普兩個TNF抑制劑。英夫利西單抗在國內獲批的適應癥有類風濕關節炎、強直性脊柱炎、銀屑病等。依那西普注射液獲批的適應癥有類風濕關節炎和強直性脊柱炎。
據米內網數據, 2017年中國公立醫療機構終端西安楊森的英夫利西單抗銷售額為3.14億元,同比增長31.80%,輝瑞的注射用依那西普銷售額為4593萬元,同比下滑23.07%。而注射用重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白(依那西普類似藥)的銷售額為9.70億元,同比增長25.75%,三生國健藥業的(益賽普)占據87.49%的市場份額。
在國內阿達木單抗類似藥未上市的情況下,另一個替代品種諾華的司庫奇尤單抗(蘇金單抗)也即將在國內上市。蘇金單抗是諾華開發的全球首個上市的IL-17A全人源單抗,獲批的適應癥有斑塊狀銀屑病、銀屑病關節炎、強直性脊柱炎等。據諾華財報,2018年蘇金單抗全球銷售收入為28.37億美元,同比上年增長37%,是諾華產品線的主力之一。
蘇金單抗全球銷售情況(單位:億美元)
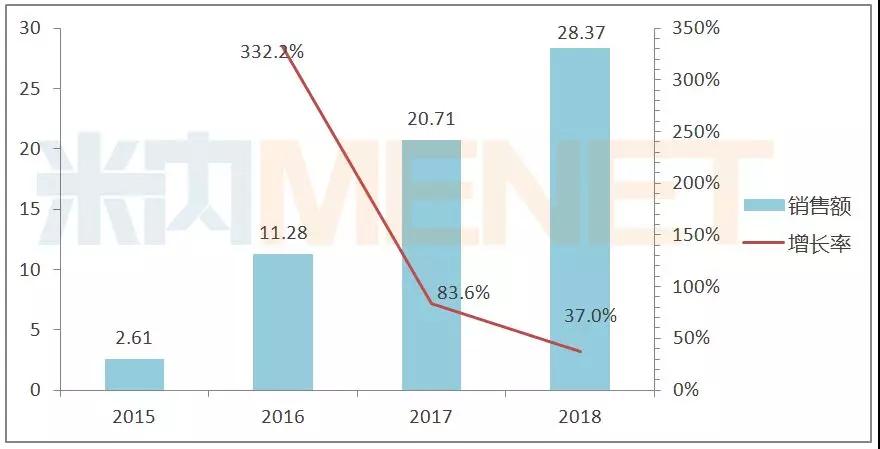 2018年9月21日,諾華司庫奇尤單抗(蘇金單抗)的進口新藥上市申請獲國家藥監局受理,2019年3月15日,該上市申請受理狀態已經變更為“在審批”,預計4月份獲批上市。按照蘇金單抗上市強勁的發展勢頭,修美樂的市場份額將進一步被瓜分。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|