
|
|
|||||
|
||||||
2019年Q1創新醫療器械特別審批有哪些新進展?摘要:
醫藥網4月23日訊 自《創新醫療器械特別審批程序》實施以來,加速推進了創新性強、技術含量高、臨床需求迫切的醫療器械產品上市,同時加快了高端醫療器械國產化替代的步伐。
一、創新醫療器械審批現狀
截至2019年第一季度,已有225個產品進入創新醫療器械特別審查通道,其中57個創新醫療器械通過特別審批程序上市。這些產品多為國內首創、國際原創或具有重大技術提升,填補了相關領域的空白。其中2019年一季度新增15個,有3個產品獲批上市。
從產品獲批情況來看,每年通過創新醫療器械特別審批程序上市的產品數量持續增長。據統計,創新優先后的平均審評審批時間較其他普通三類首次注冊產品平均壓縮83天,創新產品從研發到上市的時間進一步縮短。
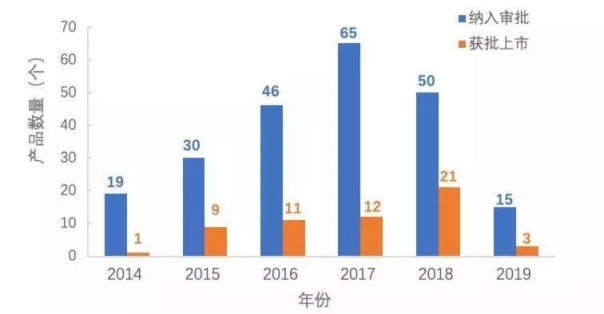 圖1 2014—2019年創新醫療器械審批上市情況
二、地域層面以產業大省領跑為主
1.北上廣蘇四個產業大省被納入特別審批的創新醫療器械數量處于第一梯隊(進口產品除外),其中北京有46個,高居首位,高于上海(38個)、廣東(36個)和江蘇(31個)。另外,北京獲批產品數量同樣排首位(19個),高于上海(11個)、廣東(10個)和江蘇(8個)。
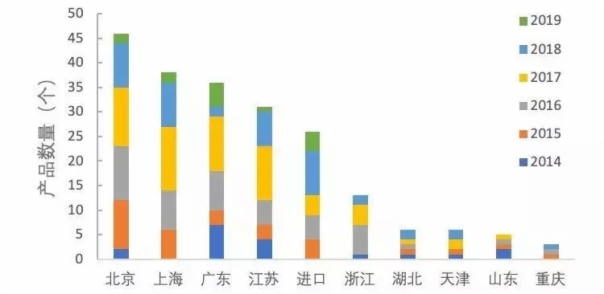 圖2 2014—2019年納入特別審批的創新醫療器械產品數量
2.分析北京在加速創新醫療器械上市方面,處于領先地位的原因可能有:
(2)在產品檢驗環節,北京市醫療器械檢驗所對所有創新醫療器械產品檢驗優先服務,一些科技含量較高的大型醫療器械檢驗周期由過去的將近3個月縮短為1個半月,所有創新產品檢驗周期平均縮短1/3以上。
(3)北京市藥監局將創新醫療器械產品許可審批與產品質量體系核查同步進行,企業獲得國家藥監部門頒發的醫療器械注冊證書后,最快當天就可從北京市藥監局領取生產許可證。
(4)北京市藥監局對職責范圍內的二類創新醫療器械審批也全面提速,開通綠色通道,全流程審批時限由170天縮短至平均22天。
三、創新醫療器械類型分布
1.植介入耗材占比最高,血管支架優勢明顯。
從產品類型上看,以植介入器械等高值耗材為主的產品占比最高,尤其是血管介入類產品中的血管支架。
目前已有4款血管支架通過創新醫療器械特別審批程序上市,分別為上海微創醫療的分支型主動脈覆膜支架及輸送系統,北京華脈泰科的腹主動脈覆膜支架系統,樂普醫療的生物可吸收冠狀動脈雷帕霉素洗脫支架系統,微創心脈的腹主動脈覆膜支架及輸送系統。
2017年,百心安、阿邁特、信立泰和脈全的生物可吸收冠狀動脈雷帕霉素洗脫支架系統也被納入了特別審批程序,我國血管支架產業的競爭力處于全球領先地位,在眾多高端醫療器械中有望最先實現國產化替代。
2.體外診斷、醫學成像等領域的首創重磅產品不斷獲批
艾德生物的“人類10基因突變聯合檢測試劑盒”(維惠健TM)是首個跨癌種的NGS伴隨診斷產品,也是我國現有獲批NGS產品中獲批基因數目最多、靈敏度最高的試劑盒,檢測范圍覆蓋了肺癌、結直腸癌目前已上市的所有靶向藥物需要檢測的基因(EGFR/ALK/ ROS1/ RET/ KRAS/ NRAS/ PIK3CA/ BRAF/ HER2/ MET)。
上海聯影自主研發了我國首臺一體化正電子發射斷層掃描及磁共振成像系統,獲批上市后在復旦大學附屬中山醫院正式裝機應用,填補了國內該領域的空白。
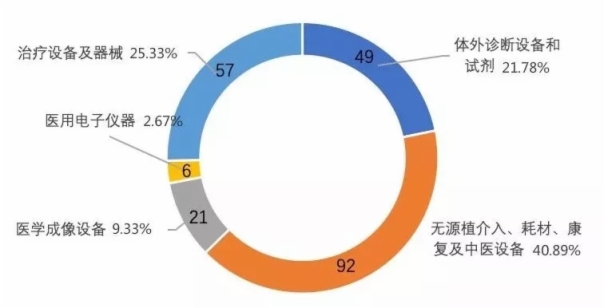 圖3 我國創新醫療器械類型分布
四、申請人獲批情況
在180多家公司中,微創醫療及其子公司被納入創新醫療器械特別審批的數量較多,共有15個產品,其中5個產品已獲批上市,包括2個電生理產品、2個覆膜支架和1個血管重建裝置。
先健科技共有8個產品被納入特別審批,其中左心耳封堵器系統和植入式心臟起搏器分別于2017年6月和12月獲批上市,在國內封堵器和心臟起搏器領域建立了明顯優勢。北京品馳醫療有2套神經刺激電極套件獲批,上海聯影的4個醫學成像創新醫療器械中有2個已獲批,博奧生物的2個核酸檢測產品均獲批,艾德生物的2個基因檢測試劑盒也均獲批。
五、小結
從創新醫療器械認證和獲批的數量和時間上,均能反映出《創新醫療器械特別審批程序》的實施對創新醫療器械加速上市具有推進作用。從行業監管的角度來看,各地監管部門可以參考借鑒北京、上海等地在加速審評審批和檢驗檢測服務商的經驗,加強本地區醫療器械的創新和產品上市。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|