
|
|
|||||
|
||||||
臨床試驗默許制開閘9個月,恒瑞、石藥等布局最快!摘要:
醫藥網5月6日訊 自2018年11月5日國家藥品監督管理局藥品審評中心公布首批臨床試驗默示許可公示8個受理號,至2019年4月27日,咸達數據V3.5發現,國家藥品監督管理局藥品審評中心已公布577個受理號默認批準臨床。這意味著藥物臨床試驗審評審批“默許制”的落地已常態化。
2018年7月27日,國家藥品監督管理局發布了《關于調整藥物臨床試驗審評審批程序的公告》,標志著我國藥物臨床試驗審評審批制度正式由審批制變為到期默認制。《公告》明確,在我國申報藥物臨床試驗的,自申請受理并繳費之日起60日內,申請人未收到國家藥品監督管理局藥品審評中心否定或質疑意見的,可按照提交的方案開展藥物臨床試驗。
那么,哪些產品進入臨床試驗默許?從中透露出哪些研發動向?
注冊分類
化學藥 PK 生物藥 PK 中藥
577個受理號中,屬于化學藥的有356個,生物制品有206個(其中,預防用生物制品21個,治療用生物制品185個),中藥15個。
化學藥:新藥申報活躍
化學藥申報中,屬于國內新藥申報的有146個,進口申報的有135個,補充申請的有40個,仿制藥申報的有35個。
國內新藥中,新1類新藥(境內外均未上市的創新藥)129個,是最主要的申報分類。
進口藥方面,進口新藥新1類的申請受理號55個,5.1類(境外上市的原研藥品申請在境內上市)34個,5.2類(境外上市的非原研藥品申請在境內上市)23個。
化學藥仿制藥方面,新3類(仿制境外上市但境內未上市原研藥品的藥品)18個,新4類(仿制境內已上市原研藥品的藥品)14個,舊6類(已有國家藥品標準的原料藥或制劑)3個。
化學仿制藥:吸入劑最受青睞
值得注意的是,新注冊分類5.2類也可以臨床默許了。仿制藥此前啟動的BE備案制只適用于國內仿制藥新3類和新4類,進口仿制藥5.2類申報仍需要報臨床。因此,臨床試驗默許制實施將加快進口仿制藥在中國上市。除了印度企業和日本企業,輝瑞和諾華都在積極將自己的仿制藥業務引進中國。
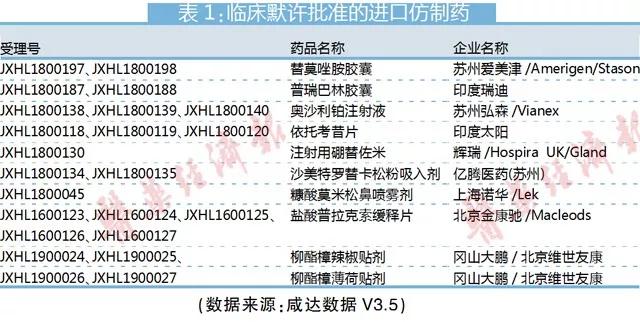 仿制藥新3類最多產品被臨床默認批準的類別是吸入劑,如吸入用色甘酸鈉溶液/色甘酸鈉吸入溶液,富馬酸福莫特羅吸入溶液和色甘酸鈉吸入溶液。
新4類則是吸入類和復雜注射劑,吸入類的產品有烏美溴銨維蘭特羅粉吸入劑、沙美特羅替卡松吸入氣霧劑、吸入用布地奈德混懸液/布地奈德吸入混懸液、丙酸氟替卡松鼻噴霧劑、吸入用硫酸沙丁胺醇溶液;復雜注射劑則有棕櫚酸帕利哌酮注射液(3個月)、注射用醋酸亮丙瑞林微球和美洛昔康混懸注射液。
生物藥:單抗類占比近五成
治療用生物制品185個受理號中,有36個是補充申請,76個是進口申請,剩下的73個全是國內新藥申請(其中1類新藥44個)。185個受理號中,有82個是單抗類藥品,占比為44%。
預防用生物制品申報較多的疫苗是凍干人用狂犬病疫苗(Vero細胞)和四價流感病毒裂解疫苗。
中藥:顆粒劑申報最多
中藥的15個批文中,有10個是新藥申請,5個是補充申請。中藥新藥申請中,1個是新4類,1個是6.1類(未在國內上市銷售的中藥、天然藥物復方制劑)。中藥顆粒劑是最多申報的劑型。新疆維吾爾自治區藥物研究所共有5個產品被臨床默認許可。
企業布局
國內標桿PK進口標桿
國內企業
No.1、恒瑞 主要領域:涉及面廣,腫瘤為主
恒瑞是國內企業最多產品被批準臨床默許的,獲批的產品有15個,包括氟唑帕利膠囊、SHR2285片(預防或治療動靜脈血栓,以及降低介入治療或體外循環引起的血栓栓塞風險)、罌粟乙碘油注射液、美洛昔康混懸注射液、SHR-2042(2型糖尿病及肥胖癥的治療)、SHR9549片(ER陽性、HER2陰性的乳腺癌的治療)、SHR2150膠囊(晚期惡性腫瘤的治療)、鹽酸右美托咪定鼻噴霧劑、注射用卡瑞利珠單抗、SHR-1222注射液(治療骨質疏松癥)、SHR0302片(治療克羅恩病)、DDO-3055片(慢性腎病所致貧血包括透析和非透析的治療)、甲磺酸阿帕替尼片、SHR3680片(治療轉移性去勢抵抗性前列腺癌,mCRPC)、注射用SHR-A1201(治療HER2陽性的轉移性乳腺癌患者),對應獲批受理號共31個。
由此可見,恒瑞的新藥研發涉及領域較多,其中腫瘤仍是其研發的主要方向。
No.2、東陽光、石藥 東陽光:治療領域分散 石藥:涉及面廣,腫瘤為主
東陽光和石藥各共有11個受理號,并列第二。
東陽光主要產品有HEC110114片(與其它直接抗病毒藥物聯用,治療慢性丙型肝炎病毒感染癥)、HEC53856膠囊(治療慢性腎臟病相關的貧血,包括透析和非透析病人)、HEC113995PA·H2O片(抑郁癥)、重組抗TNF-α全人源單抗注射液、利拉魯肽注射液。治療領域比較分散。
石藥集團研發的產品有SYHA136片(治療髖關節或膝關節擇期置換術的成年患者、預防靜脈血栓栓塞事件VTE)、SYHA1803膠囊(治療肝內膽管癌、尿路上皮細胞癌)、SYHA1402片(治療糖尿病周圍神經病變)、注射用紫杉醇陽離子脂質體和注射用紫杉醇(白蛋白結合型)。
注射用紫杉醇(白蛋白結合型)石藥已經通過一致性評價,2019年補充申請被批準臨床默認。從CDE公布的適應癥來看,2019年申請的適應癥為“適用于治療聯合化療失敗的轉移性乳腺癌或輔助化療后6個月內復發的乳腺癌。除非有臨床禁忌癥,既往化療中應包括一種蒽環類抗癌藥”。與一致性評價獲批的適應癥一致。
No.4、貝達 主要領域:堅持腫瘤藥方向
貝達藥業及其控股子公司卡南吉醫藥科技也有10個受理號獲得臨床默認批準,包括MRX2843片(治療AML、ALL等血液瘤以及實體瘤)、BPI-17509片(肝內膽管癌、膀胱癌和肺鱗癌等FGFR基因變異等實體瘤的治療)、BPI-23314片(治療惡性血液系統腫瘤,包括急性髓系白血病、非霍奇金淋巴瘤和多發性骨髓瘤)、CM082片(治療既往未經治療的局部進展或轉移性黏膜黑色素瘤)。
由此可見,貝達自埃克替尼成功案例后,堅持抗腫瘤的戰略方向。
外企
No.1、楊森 主要領域:腫瘤、免疫
進口廠家方面,楊森共17個受理號獲得臨床默認批準,烏司奴單抗注射液、Pimodivir速釋薄膜包衣片(用于急性甲型流感住院患者和高危門診患者)、人源抗CD38單抗(Daratumumab)皮下注射液(治療淀粉樣變性和高危冒煙型多發性骨髓瘤)、Guselkumab注射液(治療中重度活動性克羅恩病)、JNJ-61186372注射液(治療局部晚期或轉移性非小細胞肺癌(NSCLC))、馬昔騰坦片和阿帕魯胺片。主要方向是腫瘤和免疫系統用藥。
No.2、諾華 主要領域:腫瘤、免疫、抗過敏
諾華制藥共14個受理號獲得臨床默認批準,包括ACZ885(治療局部晚期或轉移性非鱗狀及鱗狀非小細胞肺癌)、CFZ533(治療系統性紅斑狼瘡)、VAY736(治療系統性紅斑狼瘡)、曲美替尼片、CJM112(治療低IgE以及低循環嗜酸性粒細胞水平的中至重度難控制性哮喘)、糠酸莫米松鼻噴霧劑、達拉非尼膠囊和PKC412軟膠囊。PKC412軟膠囊治療FLT3突變陽性(FLT3-MP)和FLT3突變陰性(FLT3-MN)急性髓系白血病(AML)。
No.3、阿斯利康 主要領域:腫瘤聯合療法
阿斯利康有12個受理號獲得臨床默認批準,分別是Durvalumab(聯合治療肝細胞癌、Ⅰ~Ⅲ期局限期小細胞肺癌、不可切除性局部晚期或轉移性尿路上皮癌、FIGOⅠB2期至ⅣA期宮頸癌)、Tremelimumab(聯合治療Ⅰ~Ⅲ期局限期小細胞肺癌、不可切除性局部晚期或轉移性尿路上皮癌)、Acalabrutinib膠囊(治療慢性淋巴細胞性白血病CLL)、奧拉帕利片、Pelareorep注射液(治療晚期/轉移性乳腺癌)和替格瑞洛分散片。
阿斯利康申報的臨床基本都是聯合療法,例如奧拉帕利在2018年作為首個PARP抑制劑已經在國內上市,適應癥為用于治療BRCA胚系突變鉑敏感復發性卵巢癌患者。臨床默認對應的受理號是2018年申報的,申報的適應癥為奧拉帕利與阿比特龍和強的松合并使用,用于轉移性去勢抵抗性前列腺癌患者的治療。
展望>>>
抗腫瘤依然是國內臨床研發的熱點,577個受理號中,與腫瘤相關的受理號有203個。此外,糖尿病相關的受理號68個,疼痛相關的受理號38個,也是研發熱點。
臨床試驗默認制會促進新藥研發和進口仿制藥申報增加,新藥聯合療法的申報也會增加,國內新藥有望和全球同步上市。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|