
|
|
|||||
|
||||||
醫院市場承壓!轉戰OTC,藥企必看攻略摘要:
醫藥網6月25日訊 劍指醫院用藥市場的各項改革,無疑使得處方藥面臨多重壓力。而受政策影響較小的非處方藥(OTC),有著巨大的用藥需求,則是個機會點。
那么,目前在我國,OTC的申報政策是什么情況呢?哪些類別的OTC市場機會較大?基于國際間的政策接軌,哪些類別有望獲得政策加持?
1、幾個政策“參考書”
2007年版《藥品管理辦法》
在化學藥改革以前,OTC國內的仿制申報藥品可參考2007年版《藥品管理辦法》:經原國家食品藥品監督管理局確定的非處方藥改變劑型,但不改變適應癥或者功能主治、給藥劑量以及給藥途徑的藥品;或使用原國家食品藥品監督管理局確定的非處方藥活性成分組成的新的復方制劑,都可以按非處方藥申報管理。進口藥品屬于非處方藥的,適用進口藥品的申報和審批程序,其技術要求與境內生產的非處方藥相同。
2004年發布的《非處方藥注冊審批補充規定》
《非處方藥注冊審批補充規定》中提到,已有國家藥品標準的非處方藥的生產或者進口,經原國家食品藥品監督管理局確定的非處方藥改變劑型,但不改變適應癥、給藥劑量以及給藥途徑的化學藥品,凡可進行生物等效性試驗的口服固體制劑,應當進行該項試驗,其它劑型一般不需進行臨床試驗。使用原國家食品藥品監督管理局確定的非處方藥活性成分組成新的復方制劑應當說明其處方依據,必要時需進行臨床試驗。
這意味著口服非處方藥仿制藥新上市申請在2004年時就要求進行臨床研究,而其它非口服制劑不需要。
2015年啟動化學藥品注冊改革
2015年化學藥品注冊改革,改革方案是以創新藥和仿制藥、生產廠家是國產還是進口、產品是否在國際上市等作為產品劃分的分類。仿制藥都要求通過一致性評價。無論是國外被批準為OTC的原研生產廠家產品,還是國內外廠家申報OTC產品,改革后暫未有針對OTC明確的豁免臨床研究的規定。這也是OTC類藥品近年來申報熱情不高的原因。
2019年4月發布的藥品管理法(修訂草案)
最新發布征求意見的《中華人民共和國藥品管理法(修訂草案)》,對于藥品研發和注冊,并沒有將非處方藥獨立起來。對于非處方藥,只提及國家對藥品實行處方藥與非處方藥分類管理制度,并且具體辦法由國務院制定。
這意味著非處方藥若要申請豁免臨床,必須要申請和CDE進行溝通會,才能確定能否臨床豁免。
兩批豁免或簡化BE目錄
曾經要求2018年12月底需要完成一致性評價的289目錄中,有個別產品屬于OTC Monograph被豁免了臨床。
最具代表性的為對乙酰氨基酚類,第一批《可豁免或簡化人體生物等效性試驗(BE)品種》征求意見稿和正式稿豁免了對乙酰氨基酚顆粒和對乙酰氨基酚片,第二批《可豁免或簡化人體生物等效性試驗(BE)品種》則列入了對乙酰氨基酚泡騰片和對乙酰氨基酚維生素C泡騰片。
不過,在2018年公布第二批《可豁免或簡化人體生物等效性試驗(BE)品種》之后,沒有新的目錄公布。
2、機會很大,藥企為何觀望?
參比制劑難尋,豁免法規待完善
目前公布的《可豁免或簡化人體生物等效性試驗(BE)品種》、有產品成分的豁免臨床試驗通知、包含部分產品無需開展臨床有效性試驗建議的通知,都是主要針對289目錄的口服固體制劑,其它劑型如透皮貼劑、口服液等都沒有明確的可參考的豁免法規。其中,兒科最常見的復方感冒藥的口服緩釋混懸液、滴劑等產品,就是因為臨床投入問題導致企業并不愿意仿制。
2017年,工信部制定2017年消費品工業“三品”專項行動計劃,曾提及要鼓勵發展非處方藥,培育通用名藥物大品種,形成一批品牌仿制藥。不過,2018年消費品工業“三品”專項行動計劃則改為支持醫藥企業開展仿制藥質量和療效一致性評價,全面提升仿制藥質量水平。
如果只能參照現有仿制藥一致性評價政策,非處方藥特別是OTC Monograph目錄中的產品就非常難以注冊申報了,因為這類產品的原研藥基本已經退市,參比制劑難以找到。
OTC Monograph的產品以外用鎮痛藥為例,有效成分包括苯佐卡因、利多卡因、醋酸鋁、樟腦、硫酸銅、右泛醇、布卡因、鹽酸辛可卡因、氫化可的松、薄荷醇、醋酸鋅和氧化鋅。透皮吸收的貼劑(含patch和plaster)的產品共727個產品,其中含水楊酸、薄荷醇、樟腦的產品超過100個,復方水楊酸甲酯(含薄荷醇)類貼膏劑產品國內基本沒有國產企業仿制藥。
透皮制劑機會很大,藥企“卡”在何處?
目前,我國透皮制劑類的OTC產品有苯扎氯銨貼、吲哚美辛貼片、氫溴酸東莨菪堿貼片/復方氫溴酸東莨菪堿貼膏、吲哚美辛貼片/巴布膏、醋酸地塞米松粘貼片、尿素貼膏、薄荷尿素貼膏、辣椒顛茄貼膏、水楊酸苯酚貼膏、尼古丁(透皮)貼劑和復方水楊酸甲酯薄荷醇貼劑。美國已上市的OTC Monograph透皮制劑類產品仍有不少未在中國上市。
這類產品國內暫無廠家通過一致性評價,是因為這類產品主要是在藥店終端銷售,三家通過一致性評價也不會影響廠家銷售;并且透皮制劑按此前的法規標準要求,該劑型本身就是豁免臨床。除此之外,更重要的原因是,透皮制劑的一致性評價就算要做臨床研究,該劑型臨床研究應該怎么做國內政策尚算空白,廠家也難以啟動研究。
而OTC Monograph類的貼劑若按參照FDA和舊法規的要求生產申報,連臨床研究都不需要啟動就可以有望獲批上市并視為通過一致性評價。正因為國內透皮制劑OTC藥品的質量未被認可,日韓的OTC透皮制劑產品成為大多數國人出國旅行購買的必選。
3、他山之石·美國政策
目前,美國約有800多個藥物活性成分對應10萬種藥品可以歸為非處方藥(OTC)。在美國,申報注冊非處方藥主要有兩個途徑:一是向FDA遞交非處方藥的新藥申請(NDA),以新藥遞交流程處理;另一個是通過非處方藥Monograph申請,只要所申報的藥品在Monograph上并且按照Monograph要求生產配方,則無需FDA批準就可上市。
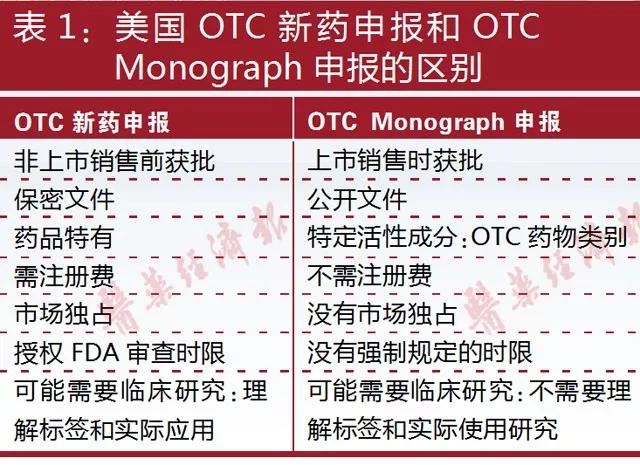 所謂OTC Monograph,就是一個怎么做OTC藥物的“配方”,列舉如何保證OTC藥物安全有效(GRASE=Generally Recognized As Safe and Effectiv)的“配方”,FDA需要評估產品的API、劑量、劑型、說明書,乃至包裝、標簽等,作為FDA OTC藥物審查計劃的一部分。
OTC Monograph的藥品分類有粉刺(Acne)、肛腸(anorectal)、抗酸(Antacid)、防齲(Anticaries)、抗真菌(Antifungal)、抗菌(Antimicrobial)、止汗藥(Antiperspirant)、咳嗽和感冒(Cough and Cold)、去頭皮屑(Dandruff)、外用鎮痛藥(External Analgesic)、洗手液(Hand-Sanitizer)、瀉藥(Laxative)、夜間助眠(Nighttime sleep aid)、眼科(Ophthalmic)、口腔保健(Oral Health Care)、戒酒藥/減肥藥(Overindulgence in Alcohol/Food)、皮膚保護(Skin Protectant)、興奮劑(Stimulant)、防曬(sunscreen)、除疣(wart remover)。
OTC Monograph無需交申請費。唯一的收費主要是OTC藥企的注冊費,FDA要求企業每年更新注冊,OTC Monograph的藥品注冊信息是OTC藥企以電子方式提交使用帶編碼數據字段的SPL文件。
OTC Monograph包含1972年之前在美國上市的所有非處方藥。對于1972年以后上市的或者從未在美國上市的非處方藥,若申請方覺得產品符合Monograph所要求的GRASE,就可以先遞交Time and Extent Application(TEA)給FDA,證明產品可以被考慮到非處方藥審批程序里(Monograph);如果FDA同意了,產品只需要遞交安全和有效性數據給FDA,證明符合GRASE。
展望
在歐、美、日,處方藥和非處方藥的注冊管理是有所不同的,但目前國內并沒有將其區分。
非處方藥作為藥店終端非常重要的產品品類,國內近年來獲批的仿制藥數量較少,中國加入ICH后接軌國際法規,簡化非處方藥的注冊非常有必要。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|