
|
|
|||||
|
||||||
官方明確仿制藥注冊標(biāo)準(zhǔn)和藥典標(biāo)準(zhǔn)關(guān)系!摘要:
醫(yī)藥網(wǎng)8月5日訊 8月2日,國家藥品監(jiān)督管理局網(wǎng)站發(fā)布了《關(guān)于仿制藥質(zhì)量和療效一致性評價工作中藥品標(biāo)準(zhǔn)執(zhí)行有關(guān)事宜的公告》,明確仿制藥注冊標(biāo)準(zhǔn)和《中華人民共和國藥典》(以下簡稱《中國藥典》)等國家藥品標(biāo)準(zhǔn)的關(guān)系。
根據(jù)有關(guān)規(guī)定,藥品注冊標(biāo)準(zhǔn)中收載檢驗(yàn)項(xiàng)目多于(包括異于)藥典規(guī)定或質(zhì)量指標(biāo)嚴(yán)于藥典要求的,應(yīng)在執(zhí)行藥典要求的基礎(chǔ)上,同時執(zhí)行原注冊標(biāo)準(zhǔn)的相應(yīng)項(xiàng)目和指標(biāo)。
上述公告指出,由于溶出度、釋放度等項(xiàng)目在質(zhì)量控制中的特殊性,按仿制藥質(zhì)量和療效一致性評價要求核準(zhǔn)的仿制藥注冊標(biāo)準(zhǔn)中有別于《中國藥典》等國家藥品標(biāo)準(zhǔn)的,國家藥品監(jiān)督管理局藥品審評中心在審評結(jié)論中予以說明,申請人在產(chǎn)品獲批后三個月之內(nèi)向國家藥典委員會提出修訂國家藥品標(biāo)準(zhǔn)的建議。
國家藥典委員會收到修訂國家藥品標(biāo)準(zhǔn)的建議后,按照有關(guān)工作程序進(jìn)行技術(shù)評估,決定是否立項(xiàng)開展相應(yīng)的國家藥品標(biāo)準(zhǔn)修訂工作。在《中國藥典》等國家藥品標(biāo)準(zhǔn)完成修訂之前,生產(chǎn)企業(yè)可按經(jīng)核準(zhǔn)的藥品注冊標(biāo)準(zhǔn)執(zhí)行。
平均審評周期約534天
國泰君安發(fā)布的一項(xiàng)報告顯示,截至7月15日,仿制藥新標(biāo)準(zhǔn)申報品種平均審評周期約為534天。目前共89個品規(guī)通過新標(biāo)準(zhǔn)申報獲批(視同)通過一致性評價,其中審評時間最短的為信立泰的替格瑞洛片(60mg),僅用130天;審評時間最長的為恒瑞醫(yī)藥的吸入用地氟烷,共用 1223 天。
已上市仿制藥的一致性評價平均審評周期約213天。目前,共222個已上市仿制藥申請通過一致性評價,其中審評時間最短的為華潤雙鶴的米非司酮片,僅用51天;審評時間最長的為石藥集團(tuán)的阿莫西林膠囊,經(jīng)過兩次補(bǔ)充審評用時481天獲得通過。
那么,按照這兩項(xiàng)平均審評周期估算,目前距離年底預(yù)計的開標(biāo)時間尚余4~5個月時間,期間可能仍有部分企業(yè)通過新標(biāo)準(zhǔn)申報或已上市仿制藥的一致性評價加入到集采的競爭行列。預(yù)計在12月1日前,氨氯地平口服常釋劑型、蒙脫石散劑和替諾福韋二吡呋酯口服常釋劑型等品種可能進(jìn)入。
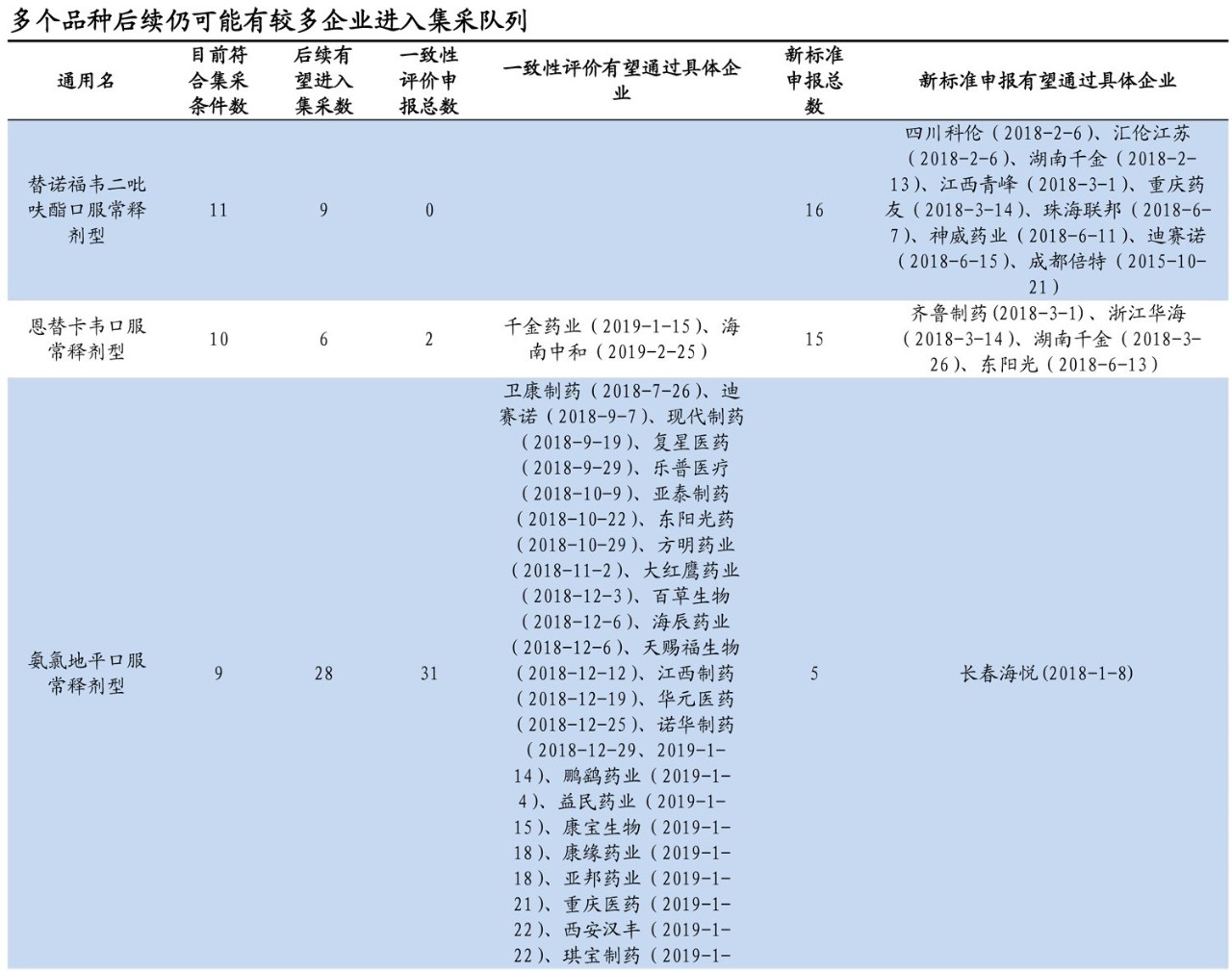  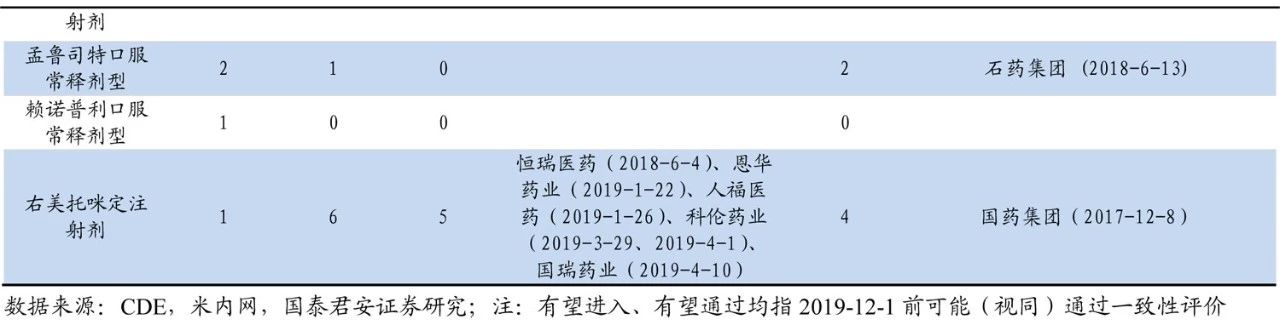 企業(yè)立項(xiàng)更為謹(jǐn)慎
采訪中,記者了解到,由于一致性評價研發(fā)費(fèi)用高昂,目前企業(yè)立項(xiàng)變得越來越謹(jǐn)慎。
從上市公司公告的已通過品種研發(fā)費(fèi)用來看,共有18個品種在100萬~500萬元區(qū)間,32個在501萬~1000 萬元區(qū)間,10個超過1000萬元;而且 100萬~500 萬元區(qū)間中的多個品種為境內(nèi)外共線品種,申報材料已相對完備,故而可能花費(fèi)較少。雖然部分省份,如浙江、甘肅等,對于前三家通過一致性評價的藥品生產(chǎn)企業(yè),每個品種一次性獎補(bǔ)300萬元,但預(yù)計對于多數(shù)企業(yè)而言,一致性評價立項(xiàng)的成本壓力依然較大,立項(xiàng)品種多為企業(yè)相信通過評價后可以“回本”甚至“盈利”的品種。
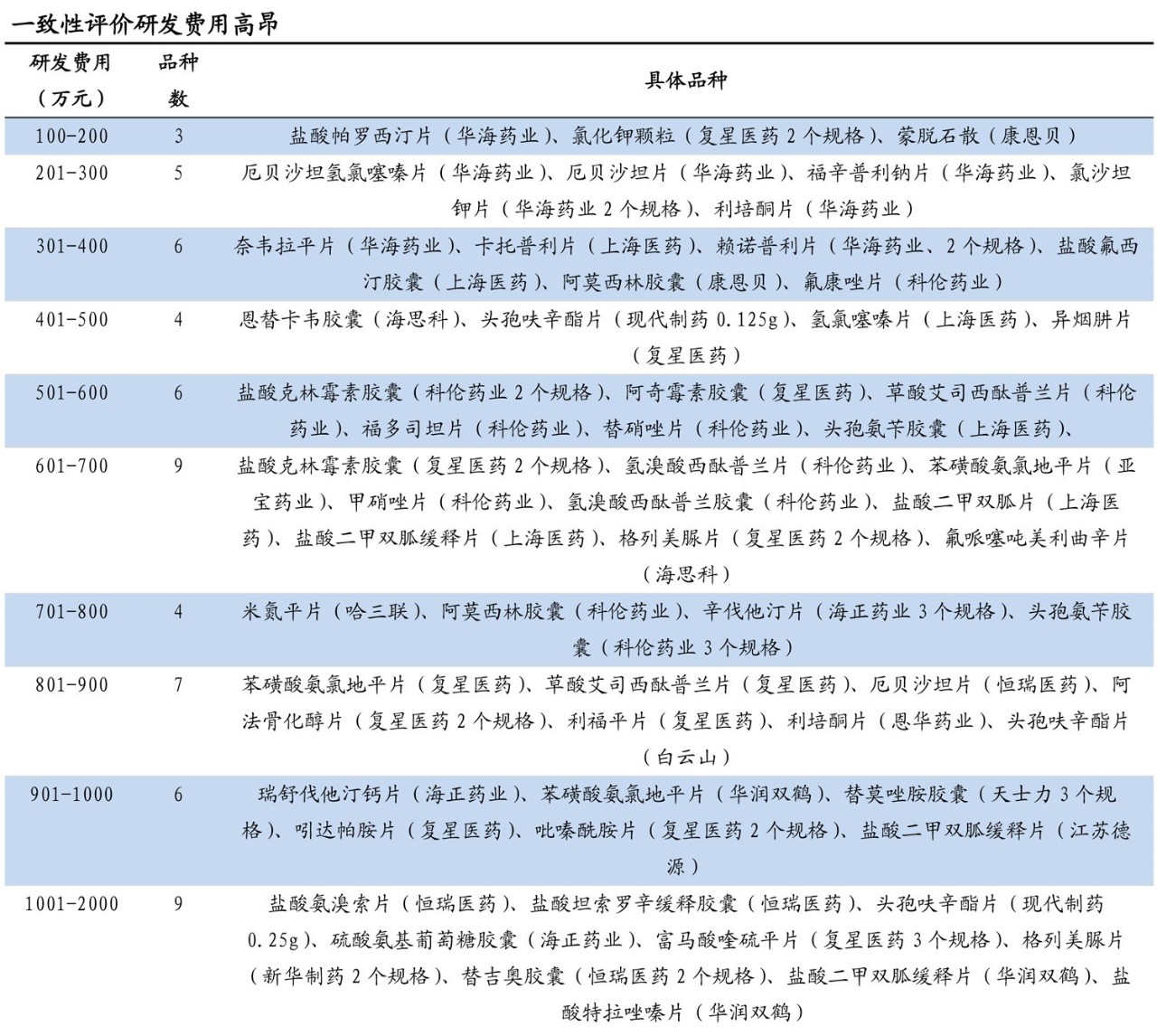 然而,第一批集采52%的平均降幅、96%的最高降幅以及獨(dú)家中標(biāo)規(guī)則使得企業(yè)“回本”風(fēng)險驟升,一致性評價立項(xiàng)變得更為審慎;即使立項(xiàng),選擇的也是一致性評價競爭格局良好、市場空間廣闊的品種。這一趨勢主要體現(xiàn)在兩個方面:第一,已上市仿制藥的BE開展節(jié)奏和一致性評價申請節(jié)奏趨緩;第二,CDE新受理的一致性評價申請多為首次申請或暫無企業(yè)通過的大品種。
若以最后通過倫理的日期作為BE試驗(yàn)起點(diǎn),企業(yè)開展BE的節(jié)奏經(jīng)過一段加速期后,在2018年5月-9月達(dá)到高峰,單月開展數(shù)一度達(dá)到70項(xiàng)左右,其后節(jié)奏開始放緩,尤其是2019年1月以來,單月開展數(shù)下降到30項(xiàng)左右。
5月20日-7月14日的8周時間里,CDE共受理161項(xiàng)一致性評價申請,涉及103個品種(以通用名+劑型計),其中35個(36.0%)是受理時同一通用名+劑型下暫無企業(yè)申請的品種;74 個(71.8%)是受理時同一通用名+劑型下暫無企業(yè)通過評價的品種。而且,這兩項(xiàng)比例近來均有所提升,反映出企業(yè)在立項(xiàng)時可能會有意選擇一致性評價格局較好的品種,避免“扎堆”競爭。
在今年“全國藥品注冊管理和上市后監(jiān)管工作會議”上,有關(guān)領(lǐng)導(dǎo)已經(jīng)明確指出,“全力推進(jìn)仿制藥一致性評價,堅持標(biāo)準(zhǔn)不降低,進(jìn)一步完善相關(guān)評價要求和指導(dǎo)原則,在保障藥品可及性的基礎(chǔ)上,分類推進(jìn)。”
從這段話中既可以看到一致性評價的進(jìn)展情況,也可以看到仿制藥下一步走向——必須通過一致性評價,否則只有被淘汰。
|
|
Copyright ?2015 廣東穗康醫(yī)藥有限公司
粵ICP備15022662號(粵)
-技術(shù)支持:信息管理部|聯(lián)系我們
|