
|
|
|||||
|
||||||
科技部發布法匹拉韋治療新冠肺炎研究結果!建議盡快納入診療方案摘要:
醫藥網3月18日訊 3月17日,記者在“國務院聯防聯控機制新聞發布會”上了解到,“法匹拉韋治療新型冠狀病毒肺炎(COVID-19)患者的安全性和有效性的臨床研究”的結果已經出爐。
研究顯示,法匹拉韋(Favipiravir)可能通過加快病毒清除,達到緩解新型冠狀病毒肺炎進展的療效。
科技部生物中心主任張新民表示,“鑒于法匹拉韋安全性好、療效明確、藥品可及,經過科研攻關組組織專家充分論證,已正式向醫療救治組推薦,建議盡快納入診療方案。”
這意味著,在新冠肺炎抗病毒治療上,除了已經列入第七版診療指南的α-干擾素、洛匹那韋/利托那韋、利巴韋林、磷酸氯喹、阿比多爾之外,臨床上又將增加一種新的用藥選擇。
值得一提的是,法匹拉韋的價格要高于磷酸氯喹近10倍。
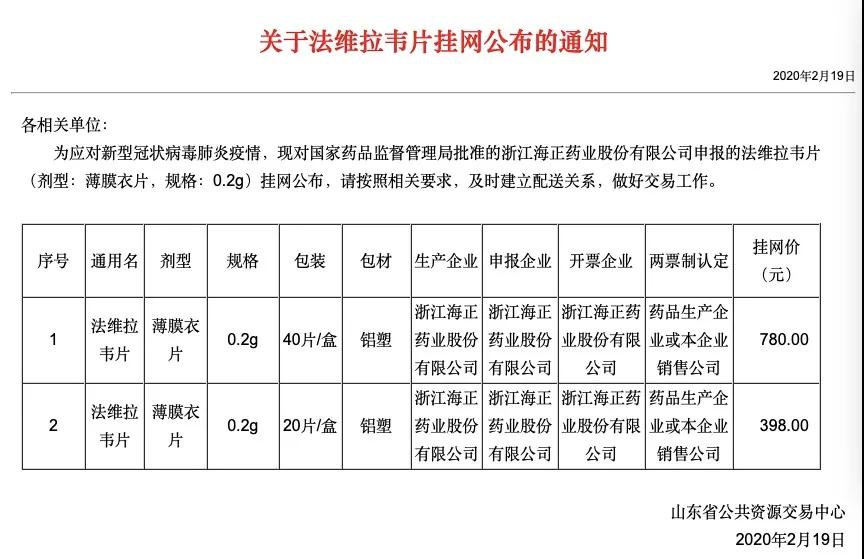 從山東省藥采平臺近期掛網的信息來看,法匹拉韋0.2g規格40片裝為780元/盒,20片裝為398元/盒。根據公開的臨床試驗用量推算,最長一療程或為14天,費用為1560元。而磷酸氯喹掛網價格,單片價格最低價只有1.79元,最高為2.6元。按照國家衛健委最新調整用量算:體重50kg以上,每次500mg,每天兩次,7天一個療程的費用約為56元。
獲批二線流感用藥
據了解,法匹拉韋的原研企業為日本福山化學有限公司,于2014年獲日本的條件性許可,商品名為Avigan。該藥物是病毒RNA聚合酶口服抑制劑,由于其作用機制,法匹拉韋被認為除流感病毒外,還可以對抗其他多種RNA病毒。
2016年,海正藥業獲得日本福山化學有限公司的許可,允許在中國研發、制造、銷售相關抗流感病毒藥物。
2月15日,國家藥監局藥審中心在受理10天后,緊急以治療流感適應癥批準海正藥業的法匹拉韋片有條件上市,成為了史上最快完成申請獲批上市的產品。
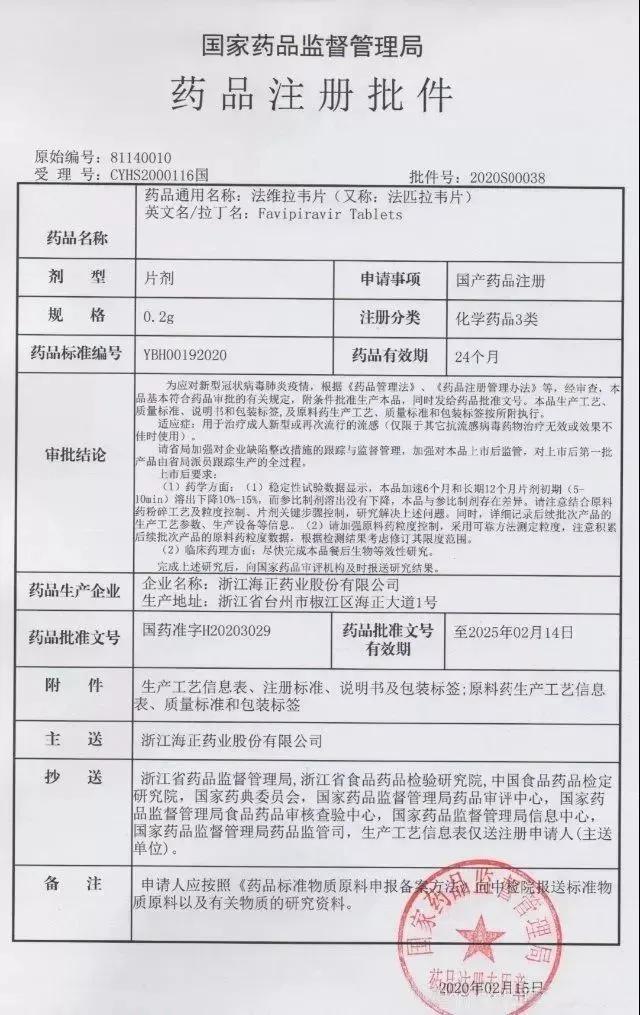 《醫藥經濟報》記者聯系到海正藥業相關負責人,他表示:“公司已經正式收到國家藥品監督管理局核準簽發的法維拉韋片(又稱:法匹拉韋片)的《藥品注冊批件》,已于2月16日正式投產,僅適用于治療成人新型或再次流行的流感(僅限于其他抗流感病毒藥物治療無效或效果不佳時使用)。”
另外,其表示,現階段公司的庫存還是在國家管控指定下做定向銷售,本月20日以后才會開始對外銷售,但僅作為醫院處方藥。
影像改善率達91.43%
發布會上,張新民介紹,深圳市第三人民醫院開展的法匹拉韋聯合干擾素治療新冠肺炎有效性和安全性研究,共計入組患者80例,其中法匹拉韋組35例,對照組45例。
研究結果顯示,在病毒核酸轉陰方面,接受法匹拉韋治療組治療后,患者病毒核酸轉陰與對照組相比,轉陰時間中位值明顯縮短,分別為4天和11天,具有顯著差異。在胸部影像學改善方面,與對照組相比,改善率分別為91.43%和62.22%。
同時,法匹拉韋在武漢大學中南醫院也開展了“治療新冠肺炎的多中心、隨機、開放、陽性平行對照臨床研究”,目前已完成各120例入組和臨床治療觀察。
臨床研究結果顯示,試驗組治療新冠肺炎的療效顯著優于對照組。
張新民表示,武漢大學中南醫院牽頭的這項研究,在主要終點評價指標方面,普通型患者在治療結束時的臨床恢復率,試驗組顯著優于對照組,分別為71.43%和55.86%。在次要終點評價指標方面,試驗組在退熱時間上顯著優于對照組,平均退熱時間分別為2.5天和4.2天。試驗組在咳嗽緩解時間上顯著優于對照組,平均咳嗽緩解時間分別為4.57天和5.98天,普通型患者在治療期間的輔助氧療或無創機械通氣率,試驗組顯著低于對照組,分別為8.16%和17.12%。以上評價指標,兩組間均具有統計學的差異。
另據中國臨床試驗數據庫查詢得知,浙江大學醫學院附屬第一醫院已于2月4日登記將法匹拉韋用于新型冠狀病毒肺炎的試驗。
 數據來源:藥智數據企業版
多企業獲批臨床
采訪中,記者還了解到,2019年法匹拉韋的中國化合物限制已到期。需要提示的是,除了化合物專利外,原研公司于2008年-2016年期間還申請了中間體、組合物、制備方法、制劑、藥品衍生物等外圍專利,形成了較為完善的專利。
具體專利情況如下表所示:
原研公司針對法匹拉韋在中國的專利布局情況
(重要專利)
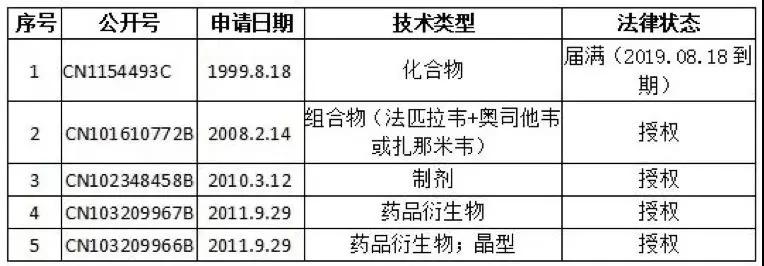 來源:藥智專利通
記者從國家藥品監督管理局審評中心還進一步了解到,目前已經申報臨床在研法匹拉韋/法匹拉韋片的機構還有軍事醫學科學院毒物藥物研究所、石藥集團中奇制藥、瑞陽制藥、四環制藥、高博京邦等,這些企業均已獲批臨床。
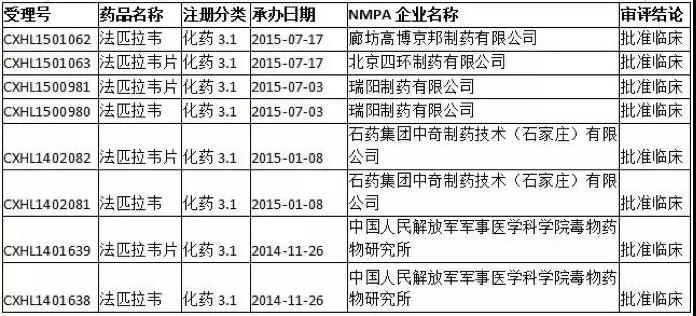 隨著新冠肺炎疫情在全球加速擴散,越來越多的藥企加入到這場抗病毒競速當中,特別是法匹拉韋專利已經到期,有理由相信隨著獲批數量的增加,法匹拉韋的價格也會為此下調。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|