
|
|
|||||
|
||||||
新政釋放利好,兒童藥四大研發熱點PK!摘要:
醫藥網6月2日訊 近幾年,兒童用藥成為了各家關注的研發方向。國內政策也逐步利好于兒童藥方向,無論是醫保還是藥品注冊都出臺了相關政策(含征求意見稿),如表1所示。
5月18日,CDE發布關于公開征求《真實世界證據支持兒童藥物研發與審評的技術指導原則(征求意見稿)》意見的通知。這是自2020年國家藥監局關于發布真實世界證據支持藥物研發與審評的指導原則(試行)的通告(2020年第1號)發布后的第一份關于真實世界應用的技術指導原則。為此,業界有觀點認為,兒童藥的真實世界研究將成為推動更多兒童藥更快上市。
那么,真實世界研究的此項政策究竟給兒童藥研發有多大的利好?兒童藥未來的研發方向在哪里?
表1 政策面利好兒童藥研發
 真實世界研究,誰的利好?
注意事項:不能作為新藥上市的依據
事實上,征求意見稿對兒童藥的真實世界研究的應用方向給出了指引。
根據征求意見稿,在兒童藥物研發中,真實世界證據的應用較常出現在以下五種情形:
1)長期用藥風險監測,如藥物對兒童生長發育的影響;
2)為滿足兒童多樣化需求的合并用藥、合并用食物等研究;
3)臨床實踐中已積累大量數據,預期可以提供針對具體問題的充分證據,如超說明書使用劑量的安全有效性數據、合并用藥數據等;
4)經過外推模型確定的兒童劑量,在外推可靠性高,安全性風險小的情況,可作為批準或條件性批準的驗證證據;
5)難以在某年齡段人群中獨立開展隨機對照臨床試驗(Randomized Controlled Trial, RCT)或某年齡段人群無法參與關鍵RCT,如早產兒、新生兒等。
目前國內已批準的案例包括:(1)真實世界證據支持上市后安全性證據收集;(2)真實世界證據支持外推劑量合理性。
其中,“真實世界證據支持外推劑量合理性”需同步參考《成人用藥數據外推在兒科人群藥物臨床試驗及相關信息使用的技術指導原則》),此案例仍然屬于藥品上市后通過豁免中國兒童臨床研究的方式增加原研藥已批準的兒童適應癥。
由此可見,真實世界的運用依然不能作為最開始上市注冊的依據,只能作為上市后的數據補充方式。
優先審評,兒童藥的傾向性?
主要劑型:顆粒劑、口服液、注射劑
CDE的納入優先審評品種名單中,三年以來,顆粒劑、口服液和注射劑依然是兒童用藥優先審批常見的劑型。
顆粒劑中,除了成都倍特的頭孢地尼顆粒、重慶華邦的對氨基水楊酸腸溶顆粒,是“申請人主動撤回并改為按與原研藥質量和療效一致的標準完善后重新申報”的仿制藥注冊申請納入優先審評程序,上海中醫藥大學的藿苓生肌顆粒暫無優先審評理由,其余都是以“兒童用藥”為理由納入優先審評程序。
北京韓美的右旋布洛芬混懸液雖是兒童用藥,但是以“申請人主動撤回并改為按與原研藥質量和療效一致的標準完善后重新申報”的仿制藥注冊申請納入優先審評程序。
帶“兒”字的產品中,瑪路弘和北京國仁堂的兒童用羅培南鈉干糖漿暫無優先審批理由。
表2 兒童藥優先審評品種名單
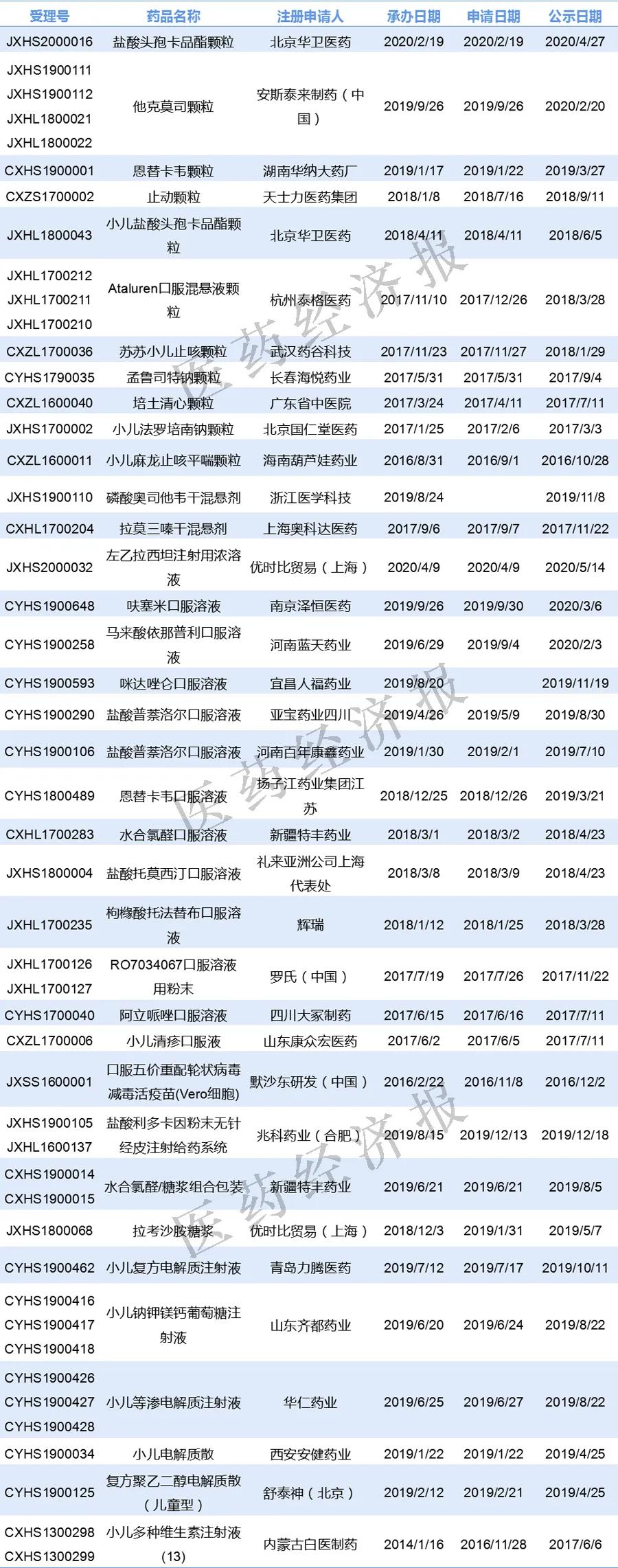 (數據來源:咸達遨游數據庫)
展望
兒童藥成為行業的熱點,其中熱點集中在研制國內未上市的兒童藥。主要有以下四個方向:
1.改良新藥:將目前已經有兒童適應癥/用法用量的口服固體制劑改為口服用的溶液劑。這個方向主要涉及的難度是矯味問題。
2.仿制國外已上市國內未上市的兒童特殊劑型產品:主要問題是境外數據的人種差異問題。從注冊流程而言,可能要先獲批成人適應癥再用外推劑量合理性獲批兒童適應癥。
3.增加國內未上市國外已上市的兒童特殊規格:需要考慮境外數據的人種差異問題。此外需要注意:特殊規格未必能在帶量采購中獲得價格優勢以及允許掛網采購必定中標資質,投資的回報價值不大。
4.兒童新藥:預計會是國內已上市的新藥往兒童方向發展。但是,由于國內沒有像歐美那樣,增加兒童的適應癥和用法用量可以延長數據保護期或專利保護,國內新藥企業開發兒童適應癥動力稍不足。而且,近幾年獲批的新藥以腫瘤為主,成人適應癥的市場規模可觀,兒童的病例罕見,愿意開發的動力更不足。
鑒于上述原因,第一種和第二種將會是短期內兒童藥物研發的熱點。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|