
|
|
|||||
|
||||||
藥監局最新通知 33家藥企被點名摘要:
醫藥網9月9日訊 近日,江西省藥監局發布《關于開展2020年藥品制劑生產企業不良反應報告和監測檢查工作的通知》。
建立健全藥品不良反應監測體系,設立專門機構,配備專職人員,建立健全相關管理制度,直接報告藥品不良反應,開展藥品風險獲益評估,采取有效風險控制措施。整理相關資料,形成自查報告,于10月15日前將自查報告電子版報省藥品不良反應監測中心。
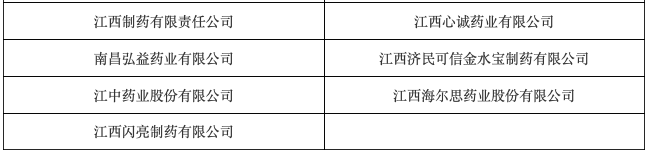
根據通知要求,江西省藥監局將組織檢查人員對以下名單內企業開展不良反應報告和監測現場專項檢查,一共33家藥企,檢查時間為9月下旬。
  藥企必須重視這項工作
藥品不良反應報告和監測,是指藥品不良反應的發現、報告、評價和控制的過程。藥品不良反應報告數量越多,并不說明藥品安全水平下降,而是意味著監管部門掌握的信息越來越全面,對藥品的風險更了解,風險更可控。
幾乎所有的藥物都可引起不良反應,只是反應的程度和發生率不同。由于藥品的特殊性,上市前研究非常局限,需要通過廣泛的臨床應用方能發現其固有的風險。因此,通過加強藥品不良反應報告和監測工作,及時發現藥品潛在固有風險,評價其風險效益比,不斷完善藥品的安全性信息,保護公眾的用藥安全。
國家藥監局藥品不良反應監測中心在4月10日發布《國家藥品不良反應監測年度報告(2019年)》顯示,2019年全國藥品不良反應監測網絡收到不良反應報告表151.4萬份,其中新的和嚴重藥品不良反應/事件報告47.7萬份,占同期報告總數的31.5%,較2018年下降1.6個百分點。
2019年藥品不良反應報告仍然以化學藥品為主,占比超八成,較2018年同期有所增長;中藥不良反應報告比例較2018年同期有所下降、生物制品略有上升。按照劑型統計,整體報告中注射劑占比超六成。
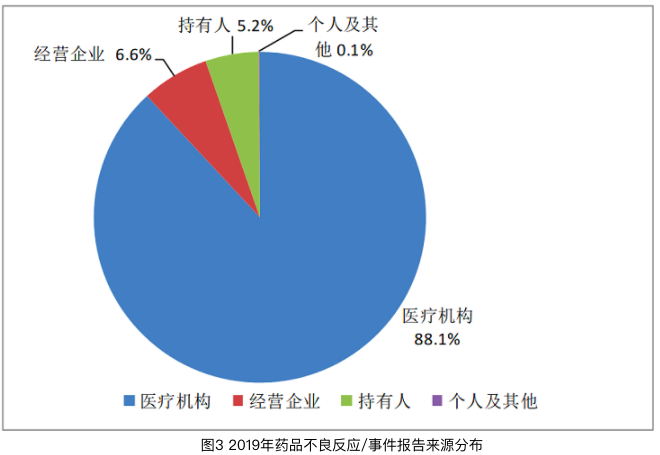
從《國家藥品不良反應監測年度報告(2019年)》數據統計來看,2019年來自醫療機構的報告占88.1%;來自經營企業的報告占6.6%;來自持有人的報告占5.2%;來自個人及其他報告者的報告占0.1%。
 據了解,美國90%的藥品不良反應來源于制藥企業。企業設有專門的機構和人員收集不良反應病例,一旦發現藥品出現意外的有害反應時,即會采取有效措。
根據新修訂的《藥品管理法》第八十條規定,藥品上市許可持有人應當開展藥品上市后不良反應監測,主動收集、跟蹤分析疑似藥品不良反應信息,對已識別風險的藥品及時采取風險控制措施。
此外,《藥品管理法》明確規定,對于持有人應報告而沒有報告不良反應的,未制定藥品上市后風險管理計劃的,責令限期改正,給予警告;逾期不改正的,處以罰款。
也就是說,作為藥品上市許可持有人的藥企必須要承擔藥品不良反應監測的主體責任。
隨著新修訂《藥品管理法》的實施,我國藥企對于藥品不良反應監測務必要越來越重視。有專家告訴賽柏藍,國內藥企若能做好藥品不良反應監測工作,國外監管部門、公眾會認為這家藥企對藥品的質量、安全性非常重視,這也將更有利于國內藥企的藥品打入歐美市場及其他發達國家市場,更好的走向國際。
可以說,藥品不良反應報告和監測,無論對企業自身還是醫藥行業的發展,都有很大的促進作用。這項工作走在前頭的藥企,也將會迎來更多的市場機會。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|