
|
|
|||||
|
||||||
最短僅29天!醫療器械創新審批和優先審批大盤點摘要:
醫藥網10月22日訊 《創新醫療器械特別審查程序》(后文簡稱“創新審批”)自2014年的試行版到2018年的修訂版,至今已正式實施了五年半的時間;《醫療器械優先審批程序》(后文簡稱“優先審批”)于2017年1月1日實施,也已走過近四年。
兩大程序是國家藥監局基于鼓勵醫療器械研發創新以及滿足臨床急需等訴求開通的醫療器械審批“綠色通道”,通過優先安排審查、加快審評審批效率等大大縮短產品上市時間,保證相應產品和成果能盡快應用于臨床,目前已經取得了顯著成效。
一、總覽
截至2020年9月30日,國家藥監局器械審評中心(CMDE)已公示了279個產品進入創新審批,其中89個產品通過該通道獲批上市;已公示了44個產品進入優先審批,其中21個產品通過該通道獲批上市。
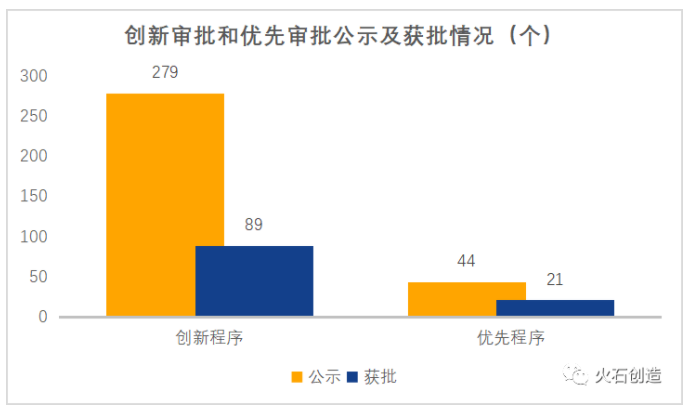 數據來源:火石創造整理自CMDE
上市速度明顯加快,審批時間有望進一步縮短。按照常規流程,二類醫療器械審批需花費2年左右的時間,三類醫療器械則需花費3年左右的時間。而據統計,已通過創新審批上市的產品從公示到獲批上市平均用時682.5天,不到2年,最快的僅用時29天;通過優先審批上市的產品平均用時386.5天,最快的僅用時103天,已大大縮短了上市時間。未來隨著經驗積累和流程優化,審批時間有望進一步縮短。
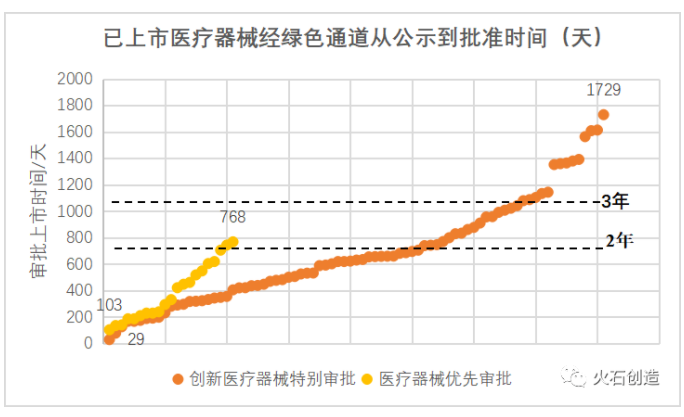 數據來源:火石創造整理自CMDE
二、創新醫療器械特別審批
自2014年3月1日實施以來,創新審批每年公示和獲批的產品數量逐年增加,在2017年前后達到高峰,而2018年修訂后,開始出現下降趨勢。
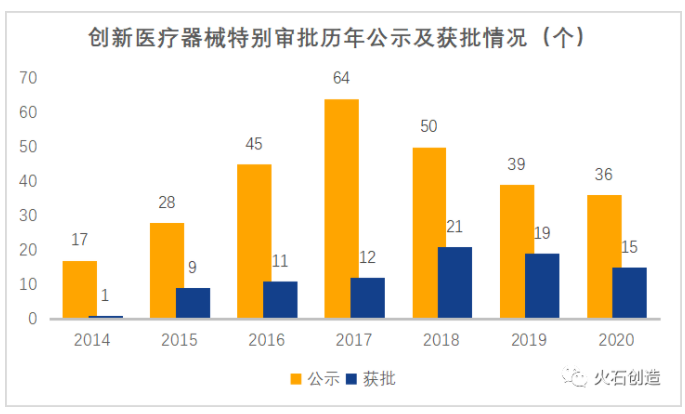 數據來源:火石創造整理自CMDE
出現上述現狀的可能原因在于:1.審查程序的內容和流程調整,導致適用情形、審批標準更加嚴格規范;2.程序開通以來,存量的具備國內首創和全球領先水平的創新產品扎堆申請,而隨著創新審批的不斷進行,具備條件的產品存量越來越少,使公示和獲批數量出現下降。這表明國產醫療器械產品創新后勁不足,企業創新投入還有待進一步加強。
高值耗材占據半壁江山。從細分領域來看,創新審批公示產品中,心血管、骨科、眼科和牙科等高值耗材占比最大,接近50%,尤其是在基本實現進口替代的血管支架領域,有眾多藥物洗脫支架、覆膜支架和可吸收支架進入創新審批;其次是醫療設備(不含體外診斷設備),占比29%;體外診斷和軟件分別占比17%和4%。
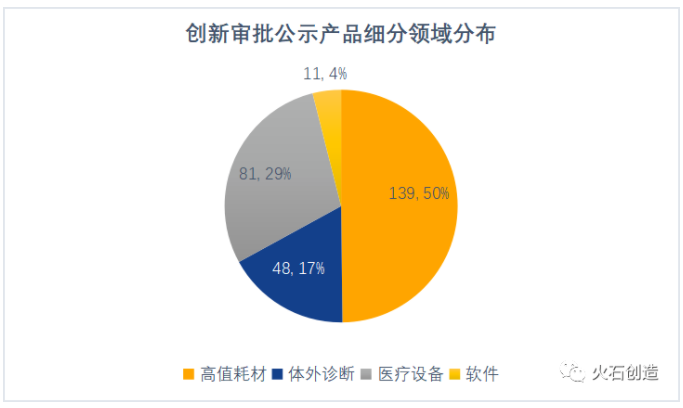 數據來源:火石創造整理自CMDE
四大集聚區占比近九成。從地域分布來看,除35個進口產品之外,長三角、珠三角、京津冀和川渝四大產業集聚區進入創新審批公示的國產產品數量占了全國的近九成。
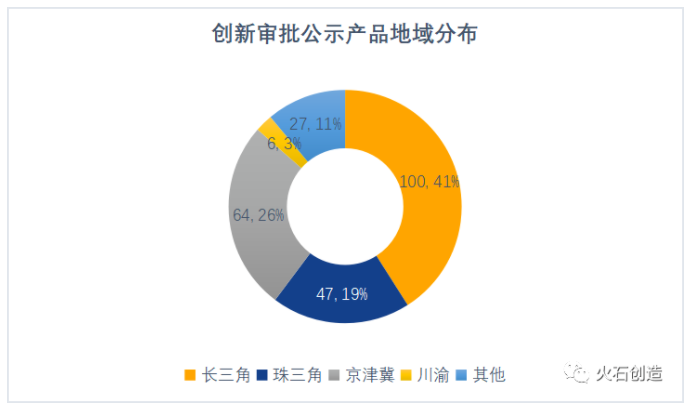 數據來源:火石創造整理自CMDE
其中,北京(56個)、廣東(47個)、上海(46個)、江蘇(36個)、浙江(17個)牢牢占據了公示數和獲批數的前五。
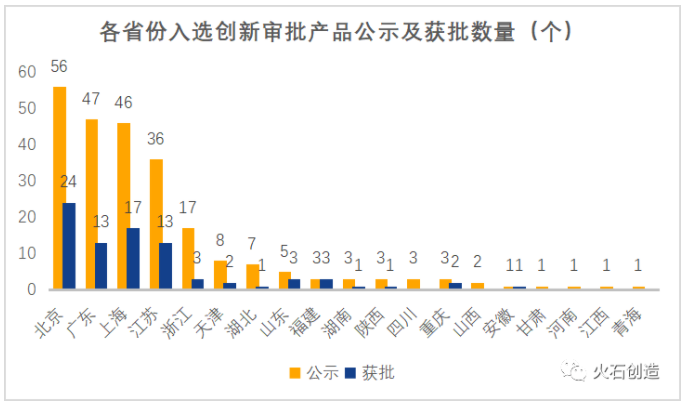 數據來源:火石創造整理自CMDE
微創醫療和先健科技產品數領先。從單家企業納入創新審批的數量來看,微創醫療憑借旗下各業務線子公司的強勢表現,成為納入創新審批和獲批上市產品數量最多的企業,其中微創心脈、微創電生理、微創神通、微創醫療機器人均有多款產品進入創新審批,并有7款產品先后經該通道上市;先健科技也憑借9款產品進入創新審批和2款產品成功上市,遙遙領先于國內其他企業。此外,北京品馳、蘇州景昱、海杰亞等企業均有產品以系統產品申報創新,而需要套件或配件之間相互配合使用,因此以多個配件或套件形式同時獲批。
三、醫療器械優先審批
自2017年1月1日實施以來,優先審批以公示44個醫療器械產品,其中21個通過該通道獲批上市,占比接近50%。
國產占七成。優先審批公示的產品中,國產產品30個,占68.2%;進口產品14個,占全部公示產品的31.8%。與創新審批的甄選標準不同的是,優先審批更加強調臨床需求,因此,其鼓勵國產創新的屬性相對較弱,這或許是優先審批有更多進口產品入選的一部分原因。
“列入國家重點研發計劃”成為最主要入選理由。優先審批主要是為了加快“診斷或者治療罕見病、惡性腫瘤、老年人特有和多發疾病、專用于兒童、臨床急需等醫療器械,以及列入國家科技重大專項或國家重點研發計劃的”醫療器械審評審批,從公示產品入選理由來看,“列入國家重點研發計劃”成為目前最主要的入選理由,其次是“臨床急需”和“列入國家科技重大專項”。
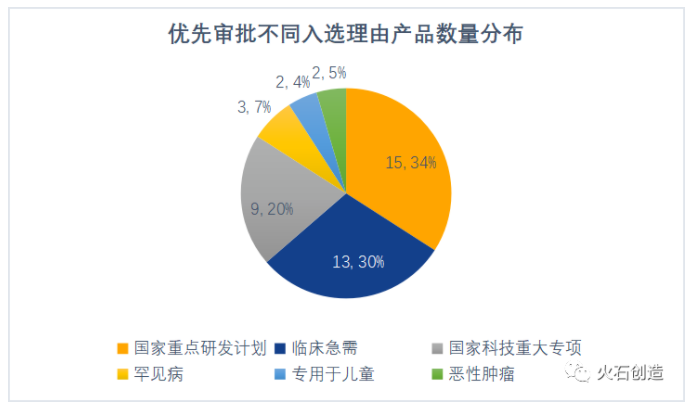 數據來源:火石創造整理自CMDE
注:本文數據均由火石創造整理自CMDE,按照注冊證編號計數(包含多個套件配合使用的系統類產品,每個套件對應一個注冊證,因此一個產品可能對應2-3個注冊證),統計截至2020年Q3。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|