
|
|
|||||
|
||||||
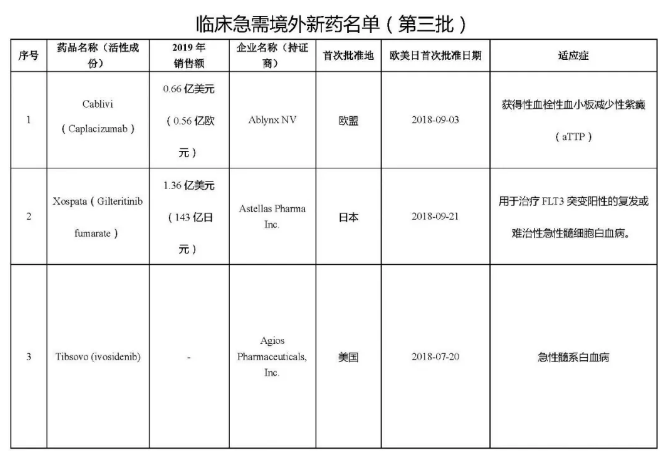
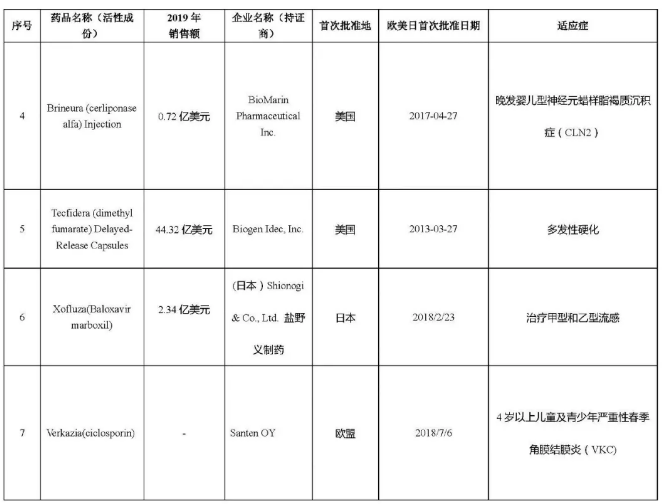
第三批臨床急需境外新藥名單公示!“重磅炸彈”在列摘要:
醫藥網10月30日訊 10月29日,CDE公示了第三批臨床急需境外新藥名單,包括丹麥制藥商Ablynx的納米抗體藥物Cablivi、安斯泰來的FLT3抑制劑Xospata、美國制藥公司Agios的白血病藥物Tibsovo等 7款境內未上市且臨床急需的特效藥,治療領域涉及血液系統疾病、惡性血液疾病、遺傳代謝性疾病、神經系統、感染性疾病和眼部疾病。
三款藥物已在國內遞交上市申請
2018年10月,國家藥品監督管理局會同國家衛生健康委員會在組織起草了《臨床急需境外新藥審評審批工作程序》,建立專門通道加快對臨床急需的境外已上市新藥進行審評審批。據悉,境外已上市臨床急需新藥名單的品種范圍主要是近年來美國、歐盟或日本批準上市我國尚未上市的,用于罕見病治療的新藥,以及用于防治嚴重危及生命或嚴重影響生活質量的疾病,且尚無有效治療手段或具有明顯臨床優勢的新藥。
而后CDE分別在2018年11月和2019年5月發布了兩批臨床急需境外新藥名單,共涉及66款藥物。據統計,截至2020年10月,包括安進的地舒單抗注射液、默沙東的帕博麗珠單抗注射液和輝瑞的氯苯唑酸軟膠囊等37款境外新藥悉數在國內獲批上市,患者迫切的用藥需求進一步得到緩解。
這次公示的第三批臨床急需境外新藥名單,其中3款藥物已經在國內遞交上市申請。今年4月,安斯泰來宣布NMPA已經受理Xospata每日一次口服療法的新藥上市注冊申請(NDA),用于治療FLT3突變陽性(FLT3mut+)的復發或難治性(治療抵抗)急性髓系白血病(AML)成人患者。目前Xospata亦已正式納入優先審評,業界預測該藥有望在2021年第二季度獲批上市。公開資料顯示,Xospata在2019年為安斯泰來創造了1.36億美元(143億日元)的銷售收入。
此外,渤健的多發性硬化癥新藥富馬酸二甲酯腸溶膠囊(Tecfidera)在今年2月提交了國內的上市申請。在2019年,渤健憑借這一款重磅小分子藥物實現了44億美元的銷售業績。目前,Tecfidera已經進入補充資料的第一輪,預計將在2021年第一季度獲批。值得注意的是,江西青峰藥業、上海匯倫江蘇藥業和力品藥業等8家本土藥企也開始布局該品種。
第三款已經在國內申報上市的是超級抗流感新藥瑪巴洛沙韋片(Xofluza)。Xofluza由日本藥企鹽野義(Shionogi)開發,羅氏在2016年與其達成了合作協議,共同負責該藥在日本和臺灣地區之外的研發工作,其中羅氏擁有除日本和中國臺灣以外地區的商業推廣權利。該藥是近20年來在美國首個獲批的抗流感藥物,憑借著全新的抗流感作用機制,Xofluza在2019年為羅氏貢獻了2.34億美元的業績。
國際化產業生態改變研發方向
在業界看來,近些年的藥政改革使得境外新藥進入中國市場的速度大大加快,在惠及國內患者的同時,也讓我國新藥研發的環境發生了較大變化。
有分析人士指出,仿制藥一致性評價正在推動我國的仿制藥質量國際化,NMPA加入ICH則是實現監管制度的國際化,監管部門鼓勵開展國際多中心臨床試驗(MRCT)體現的是創新藥研發國際化,而進口藥加速進入我國市場說明國內醫藥市場正在走向國際化,國際化的產業生態對國內制藥企業提出了全新的要求和挑戰。“這樣的環境條件要求本土藥企的新藥研發要從中國新走向全球新,從中國市場走向全球市場。”
但不容忽視的是,像PD-1/PD-L1、BTK抑制劑等熱門靶點的新藥研發已然陷入同質化的競爭紅海。面對本土藥企創新藥研發難題,有藥企研發高管指出,解決辦法無疑要從提升新藥研發的創新力度,提高新藥研發的效率和速度,以及加快國際化步伐等多個維度入手。
“在國內做首創新藥目前還面臨著較大困難,因為藥企研發基礎并不扎實,仍然存在諸多門檻,但還是要堅定該目標朝著該方向前進。當然,藥物的創新度越高也意味著研發失敗風險性越大,而且不同種類的藥物比如生物藥大分子和化藥小分子本身的成功率就有著較大差別,這就要求藥企進行深度研究。對已有靶點的藥物如何實現差異化也是突破方向,包括新適應癥開發、藥物組合創新等。此外,如何在保證藥物質量前提下,通過優化流程、采用新技術、建立關鍵技術平臺、加強轉化研究等手段,提高效率和速度,形成高效研發體系,也是新藥研發過程中的重要環節。”
  |
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|