
|
|
|||||
|
||||||
藥監局通知:2021年,新一輪飛檢全面開始摘要:
醫藥網3月18日訊
藥監局下令,2021年醫療器械全面大檢查開始
日前(3月15日),山西省藥監局最新發布了一則關于印發山西省2021年醫療器械生產企業不良事件監測工作監督檢查計劃的通知。
通知中,山西省藥監局聯合各市場監督管理局、綜改示范區市場監督管理局,省藥物警戒中心,對2021年山西省內的醫療器械監督檢查計劃進行了公示。
按照工作計劃中顯示,2021年山西省內的醫療器械大檢查將分為三大階段,分別為自查階段、檢查階段、總結階段。
檢查將采取飛行檢查的抽查模式,對于抽查中發現不符合法規要求的將責令改正,并給予警告,拒不改正的按照法規要求予以處罰。
文件的發布也就意味著,2021年山西省新一輪醫療器械大檢查即將開始。
4大項目、9大內容,重點檢查
在山西省的醫療大檢查中,3月15日-7月30日將作為第一個自查階段,各市區對轄內第一類醫療器械生產企業進行自查,省局委托省藥物警戒中心組織省內第二類及第三類醫療器械生產企業開展自查。
7月30日-9月20日將為檢查階段,局組織省藥物警戒中心根據各類醫療器械生產企業自查情況和市級監測中心工作情況進行監督抽查。
飛檢中重點抽查:1、無菌植入性高風險醫療器械及防疫物資生產企業;2、不認真落實醫療器械不良事件監測責任的企業。
9月20日-11月15日為總結階段,省藥物警戒中心必須于2021年12月10日前形成全省醫療器械不良事件監測工作匯總報告至山西省藥監局處。
按照檢查計劃顯示,2021年山西省的重點檢查將圍繞醫療器械生產企業進行。
重點檢查項目為:
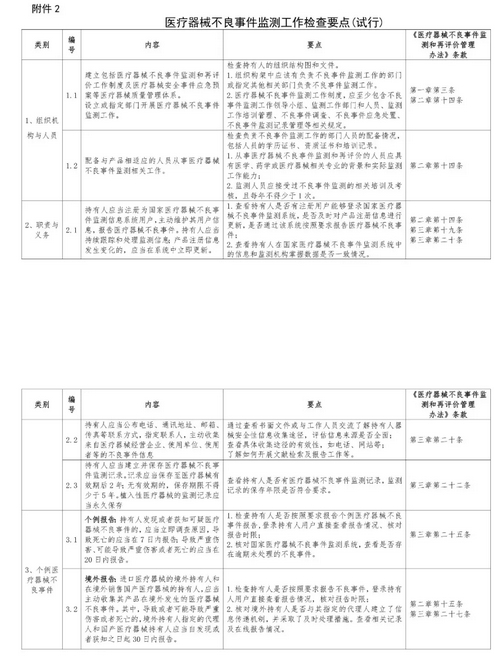
1. 醫療器械生產企業在國家醫療器械不良事件監測信息系統用戶資料注冊填報情況;
2. 醫療器械生產企業評價和處置嚴重不良事件及風險信號情況;
3. 醫療器械生產企業按規定時限編寫產品定期風險評價報告情況;
4.創新審批的醫療器械開展重點監測情況。
重點檢查內容為:
1.是否在生產質量管理體系中規定醫療器械不良事件監測相關制度和人員。
2.是否組織或參加《醫療器械不良事件監測和再評價管理辦法》相關法規培訓。
3.是否在國家醫療器械不良事件監測信息系統注冊、完善用戶信息,用戶信息中是否填寫監測負責人和聯系人信息和聯系方式,人員變動后是否及時更新。
4.是否在國家醫療器械不良事件監測信息系統登記全部產品注冊(備案)信息,新取得的注冊(備案)證書是否在30日內完成錄入工作。
5.是否按照規定時限分析、評價嚴重和死亡的醫療器械不良事件報告。
6.是否對醫療器械風險信號開展風險評價并撰寫風險評價報告,及時采取風險控制措施。
7.是否按照規定時限要求撰寫并向省藥物警戒中心提交產品定期風險評價報告。
8.是否按照要求妥善保存不良事件監測工作相關記錄和資料。
9.是否按要求對創新審批的醫療器械在首個注冊周期開展重點監測、撰寫并提交重點監測工作方案、重點監測報告和工作總結。
文件最后,山西省藥監局特別強調,為了做好監督抽查工作,省藥監局將從各市市場監督管理局、綜改示范區市場監督管理局各抽調2名熟悉醫療器械不良事件監測工作的專職人員參與檢查工作。
一經發現有企業采取的控制措施不足以有效防范風險的,采取發布警示信息、暫停生產銷售和使用、責令召回、要求其修改說明書和標簽等監管措施。
全流程監管持續強化,監管治理組合拳出擊
早在2020年4月,國家藥監局發布的《關于發布醫療器械注冊人開展不良事件監測工作指南》中就明確指出,未來要加強對醫療器械注冊人、備案人的指導、監管力度,及時、有效控制醫療器械上市后風險。
不僅如此,此前國家藥監局醫療器械監督管理司司長王者雄還表示,2021年監管部門將從落實企業主體責任、加強監督檢查、組織開展監督抽檢、做好出口產品質量監管四方面入手,全力做好疫情防控醫療器械質量監管。
在檢查中,國家藥監局將重點組織對無菌植入性醫療器械、國家集中帶量采購醫療器械、創新醫療器械、附條件審批醫療器械等產品,以及多次抽檢不合格醫療器械、投訴舉報和輿情頻發涉及質量問題等產品開展飛行檢查。
與此同時,2021年國家藥監局還將加大案件查辦力度,嚴厲打擊無證生產和生產無證產品、不符合強制性標準或產品技術要求等違法違規行為。
“今年,國家藥監局將組織對風險高、使用量大、社會關注度高、日常監管工作發現存在問題的60余個品種開展國抽,對國家集中帶量采購中選冠脈支架產品開展專項抽檢。”
據不完全統計顯示,2021年,國家藥監局共有35家醫療器械企業因飛檢不合格被公開通報,企業缺陷最高達112項。
按照此前正式通過的《醫療器械監督管理條例(修訂草案)》規定,醫療器械生產企業中,涉及生產、經營假冒醫療器械的;未經生產許可從事第二類、第三類醫療器械生產活動的;未經經營許可從事第三類醫療器械經營活動的,被處罰金額直接上調至30倍,情節嚴重的,還將直接被吊銷醫療器械注冊證、醫療器械生產許可證或者醫療器械經營許可證。
涉嫌經營、使用無合格證明文件、過期、失效、淘汰的醫療器械,拒絕或者妨礙藥監部門檢查等醫療器械違法行為,最高將被處以貨值金額10倍罰款,且直接責任人5年內不得從事醫療器械生產經營活動。
與此同時,文件中還強調,以上違法行為情節嚴重造成嚴重后果的,除了吊銷相關責任人員的許可證之外,直接負責人員10年內將不得申請醫療器械許可或者從事醫療器械生產經營活動。構成犯罪、被判處有期徒刑以上刑罰的,終身不得申請醫療器械許可或者從事醫療器械生產經營活動。
此前2月中旬,遼寧省藥監局也印發了《遼寧省藥品監督管理局2021年度監督檢查計劃》,計劃對醫療器械生產企業、進口醫療器械代理人以及醫療器械網絡交易服務第三方平臺進行新一輪全面檢查。檢查計劃于2021年11月底前全部完成,檢查方式以飛行檢查為主。
顯然,現階段已經有越來越多的省市開始著手布局2021年醫療器械大檢查工作,從工作的形式來看,目前仍以飛檢為主。
需要提醒的是,在以往各個省市乃至國家的飛檢中,往往會有多家醫療器械公司被突然襲擊后遭到處罰,輕則罰款,重則直接停產整改。對于醫療器械企業而言,如何順利遇檢過檢,無疑只有自查整改規范自身。
    |
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|