
|
|
|||||
|
||||||
一批新藥將上市:恒瑞、東陽光、正大天晴...摘要:
醫藥網7月20日訊 多款新藥上市有新進展,國內外頭部藥企均有斬獲
23款新藥上市有進展!2款國產1類新藥首次獲批
6月26日-7月16日期間,23個新藥(33個受理號)的上市申請有審評審批狀態更新。9款國產新藥獲批上市,其中2款1類新藥首次獲批,包括艾迪藥業的艾諾韋林片(曾用名ACC007片)、海正藥業的海澤麥布片;3個新藥獲批進口,安進的注射用卡非佐米、萌蒂的鹽酸羥考酮緩釋片首次獲批。
此外,神州細胞的注射用重組人凝血因子(Ⅷ)、北京博康健的注射用重組人特立帕肽、禮來的注射用鹽酸吉西他濱、賽諾菲的碳酸司維拉姆片、阿斯利康的奧拉帕利片等7個藥品的注冊辦理狀態變更為“在審批”。
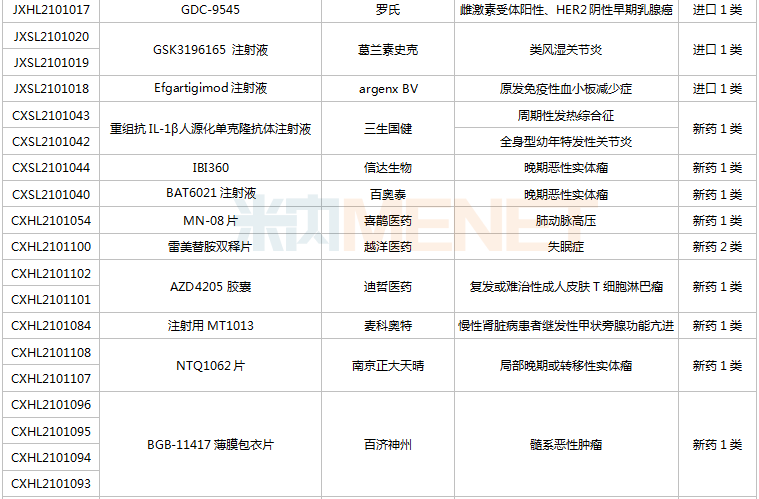
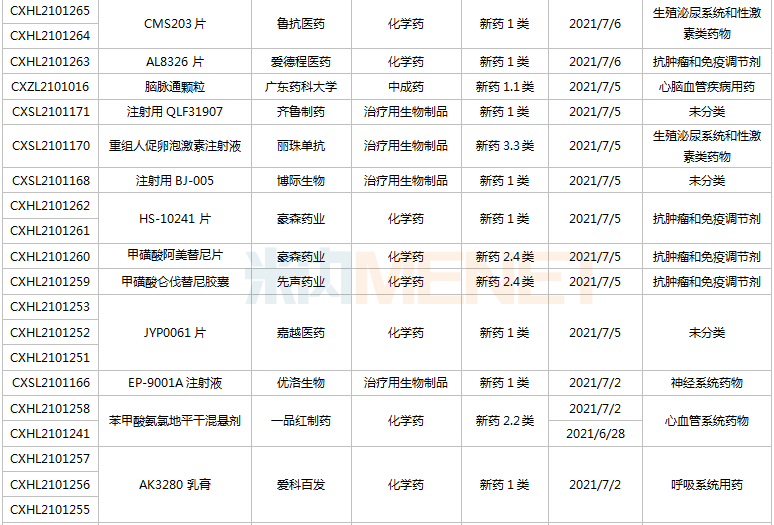
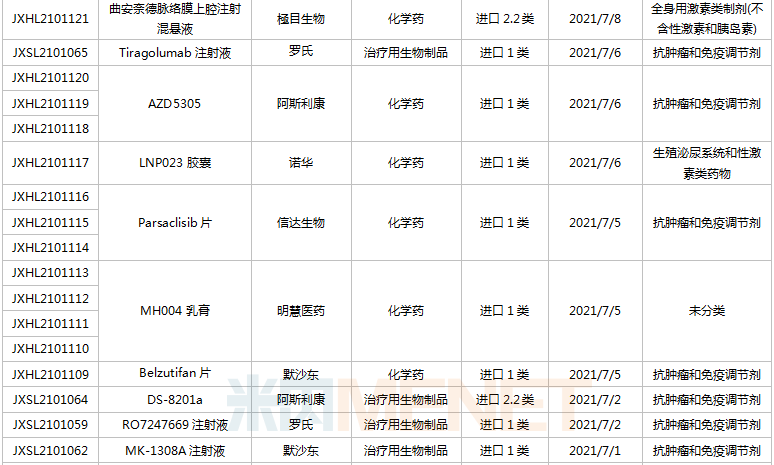
(6.26-7.16)新藥上市申請審評審批狀態更新
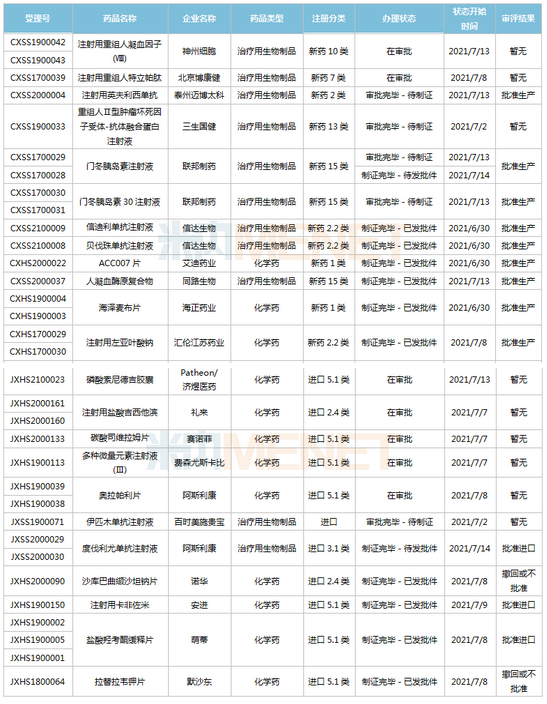 2款國產1類新藥首次獲批上市。海博麥布片是海正藥業首個獲批上市的1類新藥,這是一款膽固醇吸收抑制劑,用于治療原發性高膽固醇血癥。同靶點上市藥物為默沙東的依折麥布,全球銷售峰值達26.6億美元,2020年在中國城市公立醫院、縣級公立醫院、城市社區中心以及鄉鎮衛生院(簡稱中國公立醫療機構)及中國城市實體藥店終端合計銷售額接近10億元;艾諾韋林片(曾用名ACC007片)是全新結構的非核苷類逆轉錄酶抑制劑,是艾迪藥業首個獲批的抗艾滋病1類新藥。
聯邦制藥2款胰島素獲批上市,均為國產第2家。門冬胰島素注射液是一種速效的人胰島素類似物,門冬胰島素30注射液是由可溶性門冬胰島素和精蛋白門冬胰島素按30:70的比例組成的預混胰島素。米內網數據顯示,2020年中國公立醫療機構及中國城市實體藥店終端胰島素及其類似藥銷售規模超過300億元。
首次在國內獲批的注射用卡非佐米是百濟神州/安進聯合開發的一款蛋白酶體抑制劑,聯合地塞米松治療復發或難治性多發性骨髓瘤。該產品于2012年在全球首次獲批,2020年全球銷售額超過10億美元。
英夫利西單抗是強生/默沙東研發的一款特異性阻斷腫瘤壞死因子(TNF-α)的人鼠嵌合型單克隆抗體,全球銷售峰值達92.4億美元,雖然受到生物類似藥沖擊,但2020年仍實現40.77億美元的銷售額。泰州邁博太科藥業的注射用英夫利西單抗是國內首款獲批上市的英夫利西單抗生物類似藥,使用CHO表達系統,比原研產品更安全且免疫原性更低。
21款新藥申請上市!正大天晴、人福......4款1類新藥來襲
6月26日-7月16日期間,21個新藥(28個受理號)上市申請獲得CDE承辦。12款為國產新藥,其中4款為1類新藥,包括正大天晴康方的派安普利單抗注射液、銀珠醫藥/長城制藥的羧胺三唑軟膠囊、光谷人福的廣金錢草總黃酮膠囊及樂普生物/鼎康生物的普特利單抗注射液;10款為進口新藥,賽生醫藥的那昔妥單抗注射液、梯瓦醫藥的醋酸格拉替雷注射液、信達的Pemigatinib片、武田的Mobocertinib膠囊、康哲藥業的地西泮鼻噴霧劑、協和麒麟的莫格利珠單抗注射液為首次報產。
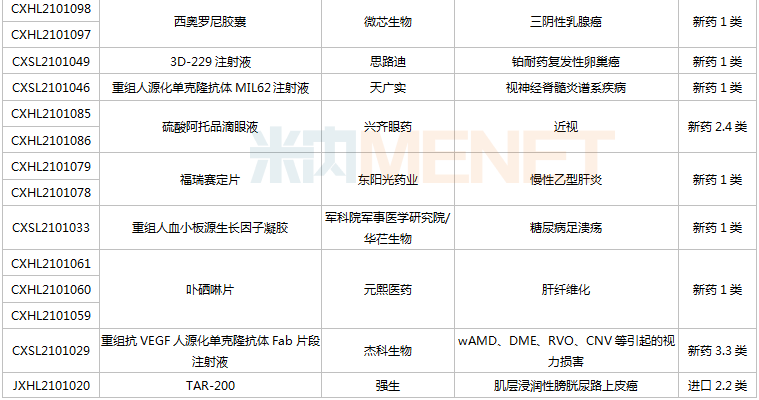
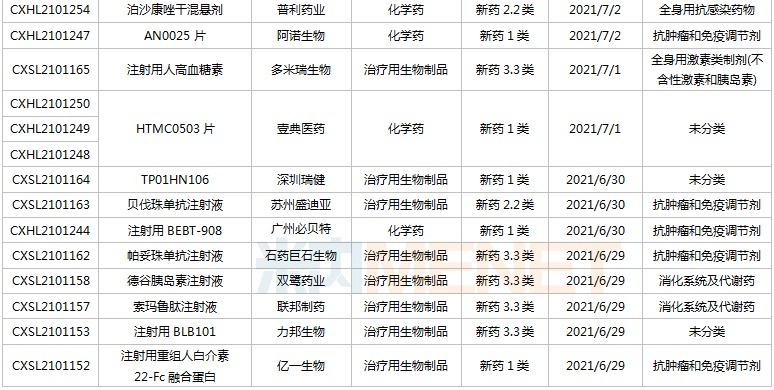
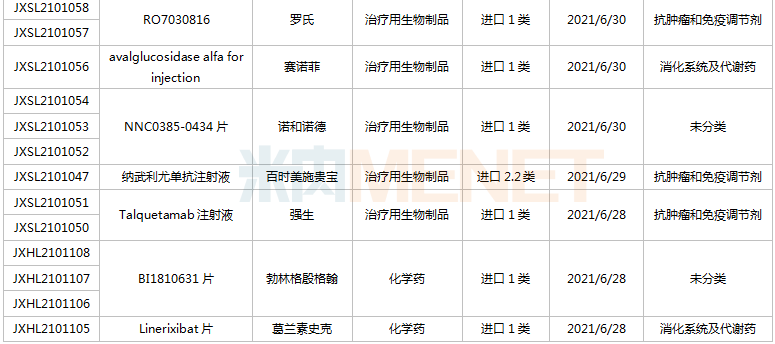
(6.26-7.16)獲承辦的國產/進口新藥上市申請
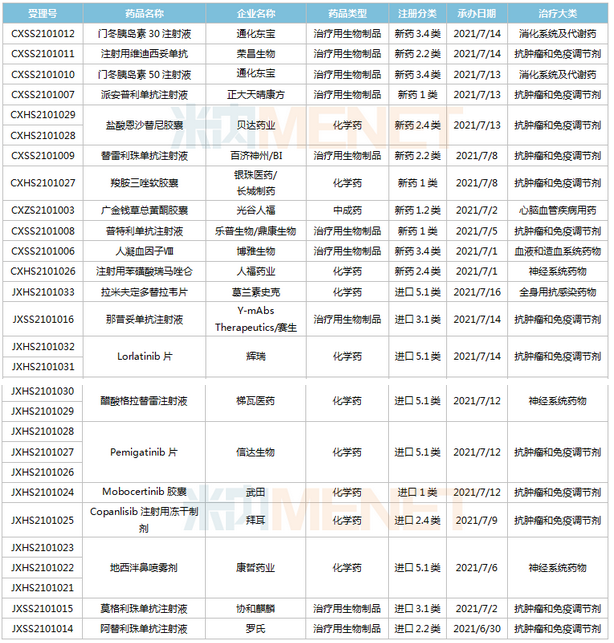 2款PD-1單抗申報上市。樂普生物的普特利單抗注射液屬于差異化設計的PD-1抗體,在IgG4的Fc引入S254T/V308P/N434A突變延長半衰期;正大天晴康方的派安普利單抗注射液具有同類最佳的潛力,與國外已上市PD-1相比抗原結合解離速率較慢。目前國內已有6款PD-1單抗獲批上市,分別為帕博利珠單抗、納武利尤單抗、信迪利單抗、特瑞普利單抗、卡瑞利珠單抗及替雷利珠單抗。此外,還有5款PD-1的上市申請還在審,包括普特利單抗、派安普利單抗、杰洛利單抗、賽帕利單抗以及斯魯利單抗。
通化東寶2款預混型門冬胰島素申報上市。門冬胰島素50注射液僅原研廠家諾和諾德的產品在售,通化東寶首家報產;甘李藥業、聯邦制藥的門冬胰島素30注射液已獲批,東陽光藥、通化東寶的產品已報產。米內網數據顯示,2020年中國公立醫療機構及中國城市實體藥店終端門冬胰島素銷售規模超過80億元。
pemigatinib片是信達生物引進的一款成纖維細胞生長因子受體(FGFR)1/2/3抑制劑,用于有FGFR2融合或重排的晚期、轉移性或不可手術切除的膽管癌。該產品已于2021年6月21日在臺灣獲批上市,是信達生物獲批的首款小分子新藥,也是公司第五款獲批上市的創新藥。
Mobocertinib(TAK-788)是武田研發的一種新型、高選擇性的“first-in-class”口服酪氨酸激酶抑制劑(TKI),擬用于治療攜帶表皮生長因子受體(EGFR)20號外顯子插入突變的非小細胞肺癌,目前全球范圍內暫未獲批,此次在中國申請上市首次實現了中國與全球的同步遞交。
協和麒麟的莫格利珠單抗注射液(Mogamulizumab)屬于抗CC趨化因子受體4(CCR4)單克隆抗體,2012年首次在日本獲批,2018年獲得FDA批準上市。Mogamulizumab有望成為國內首款“first-in-class”的CCR4抑制劑,為復發性或難治性皮膚T細胞淋巴瘤患者提供新的治療選擇。
康哲藥業引進的地西泮鼻噴霧劑結合了基于維生素E的溶劑和Intravail吸收增強劑的獨特組合,以期在鼻腔配方中獲得突出的吸收性、耐受性和可靠性。這是國內首款報產的地西泮鼻噴霧劑,用于治療六歲及以上癲癇患者的間歇性、刻板性癲癇頻繁發作活動。米內網數據顯示,2020年中國公立醫療機構終端地西泮銷售規模超過7000萬元。
那昔妥單抗注射液是賽生醫藥引進的一款神經節苷脂GD2人源化單克隆抗體,通過靶向高表達于神經母細胞瘤的GD2起效。該產品于2020年11月25日首次獲得FDA加速批準上市,用于治療復發/難治性高危神經母細胞瘤。目前全球有3款靶向GD2治療神經母細胞瘤的單抗產品獲批,國內市場暫時空白。
梯瓦的醋酸格拉替雷注射液是由谷氨酸、丙氨酸、酪氨酸和賴氨酸四種氨基酸組成一種合成肽類化合物,被認為是通過改變造成多發性硬化(MS)發病機制的免疫過程而起作用的,可降低復發性MS患者的復發頻率。該產品2020年全球銷售額為13.37億美元,可見臨床需求之大。
多款新藥新適應癥報產,包括百濟神州的PD-1替雷利珠單抗(局部晚期或轉移性食管鱗狀細胞癌)、榮昌生物的ADC藥物維迪西妥單抗(局部晚期或轉移性尿路上皮癌)、貝達的恩沙替尼(ALK陽性非小細胞肺癌)等。
科倫、東陽光藥、恒瑞......69個新藥獲批臨床,國產新藥高歌猛進
6月26日-7月16日期間,69個新藥(涉及96個受理號)獲得臨床試驗默示許可。其中,51個品種(70個受理號)為國產新藥(42個1類新藥),18個品種(26個受理號)為進口新藥。從藥品類型看,化學藥有37個、治療用生物制品有32個。
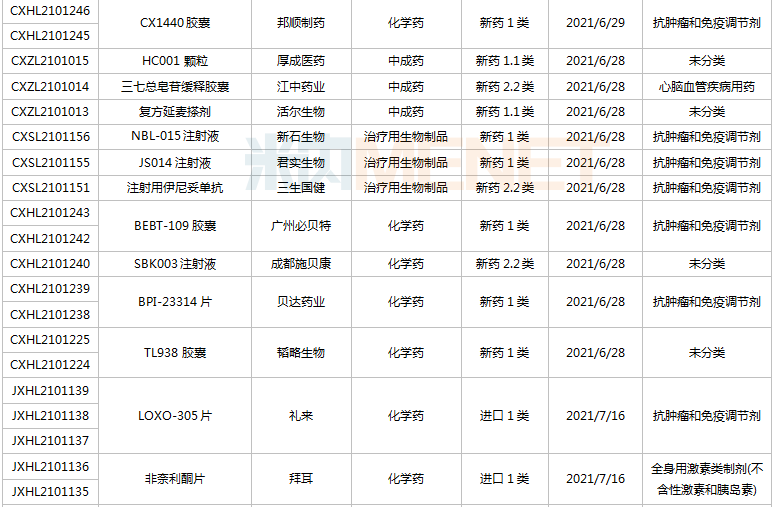
(6.26-7.16)獲批臨床的國產/進口新藥
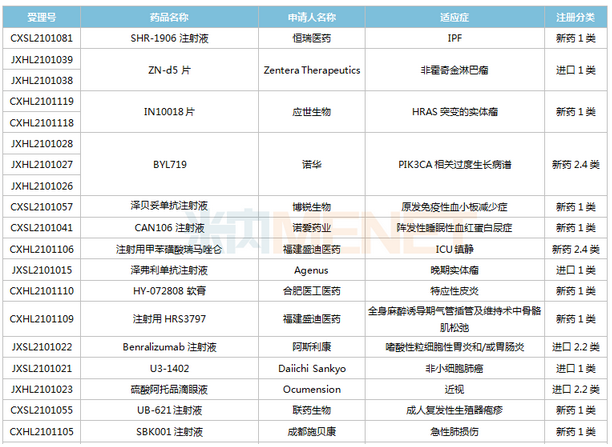 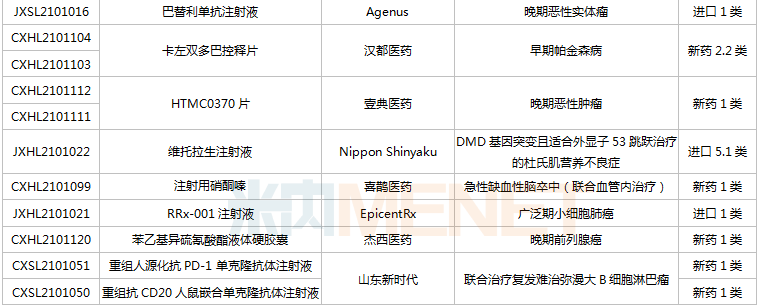   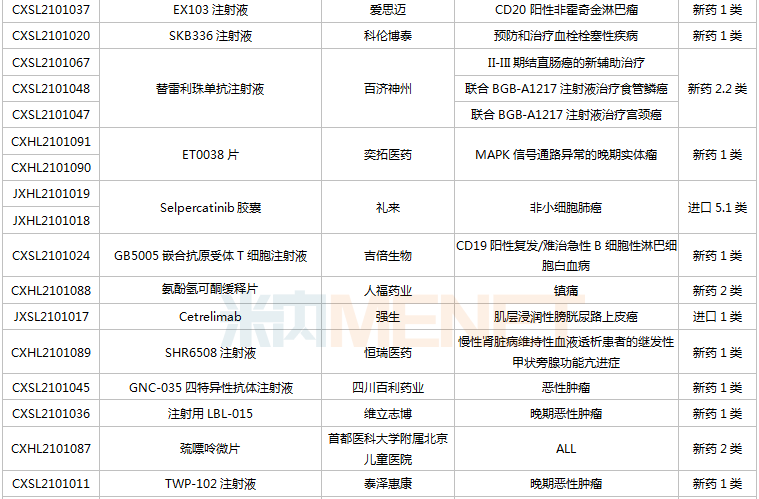  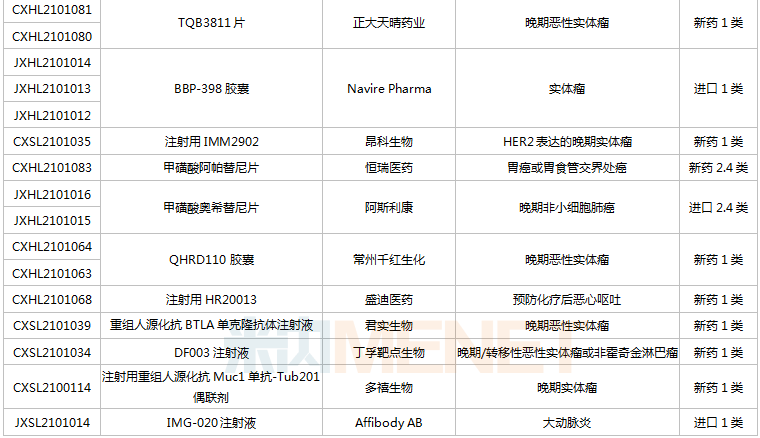 恒瑞醫藥有6款新藥獲批臨床,包括SHR-1906注射液、注射用甲苯磺酸瑞馬唑侖、注射用HRS3797、SHR6508注射液、甲磺酸阿帕替尼片、注射用HR20013。除了甲磺酸阿帕替尼片、注射用甲苯磺酸瑞馬唑侖,其余4款1類新藥均為首次獲批臨床。SHR6508注射液擬用于治療慢性腎臟病維持性血液透析患者的繼發性甲狀旁腺功能亢進,目前國內尚無同類靜脈給藥產品上市;注射用HR20013用于預防化療后惡心嘔吐,目前國內外尚未有同類產品獲批上市。
中國生物制藥2款1類新藥獲批臨床。南京正大天晴NTQ1062片、正大天晴的TQB3811片為首次獲批臨床,均擬用于治療實體瘤,作用靶點暫無詳細信息。
科倫藥業子公司博泰生物開發的1類新藥SKB336注射液是一款全新的具有自主知識產權的靶向FXIa/FXI因子的人源化單抗,目前全球尚無同靶點藥物獲批上市,在研藥物包括拜耳的BAY-1213790、諾華的abelacimab(阿貝西單抗),兩個產品均處于II期臨床。米內網數據顯示,2021年至今,科倫藥業已有7款新藥獲批臨床(不含補充申請),其中5款為1類新藥。
百奧泰的1類新藥BAT6021注射液首次獲批臨床,這是一款經無巖藻糖基化修飾的mAb候選藥物,作用靶點為TIGIT,擬用于治療晚期惡性實體瘤。目前國內暫無同靶點藥物獲批,在研藥物包括百濟神州的Ociperlimab(III期臨床)、信達的IBI939(I期臨床)、君實的JS006(I期臨床)等。
豪森、石藥、齊魯……114個新藥臨床申請獲承辦
6月26日-7月16日期間,114個新藥(涉及164個受理號)的臨床申請獲CDE承辦受理。其中,86個品種(113個受理號)為國產新藥,28個品種(51個受理號)為進口新藥。從藥物類型看,化學藥有56個、治療用生物制品有52個、中成藥有6個。86個國產新藥中,1類新藥有63個。
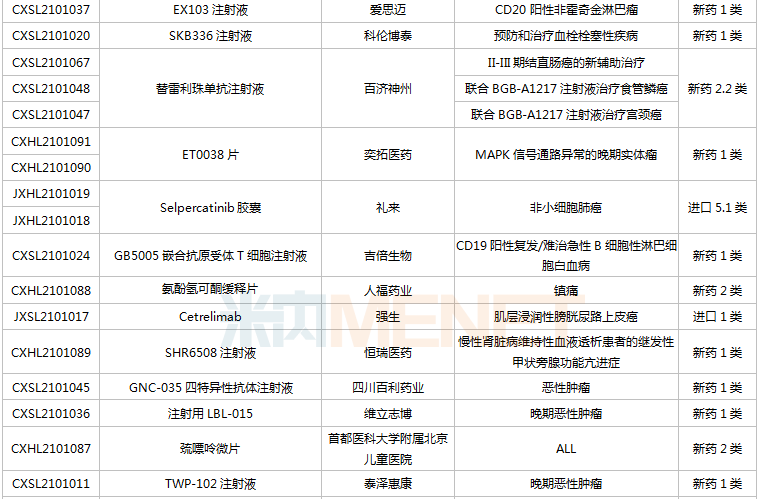
(6.26-7.16)獲承辦的國產/進口新藥臨床申請
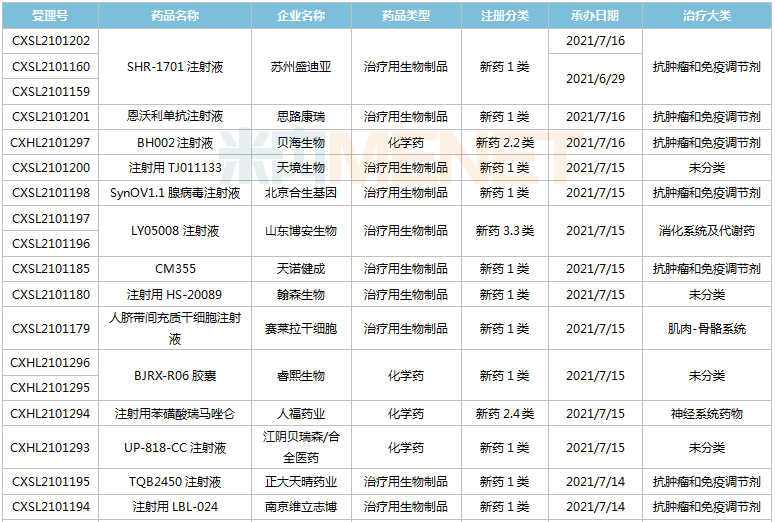 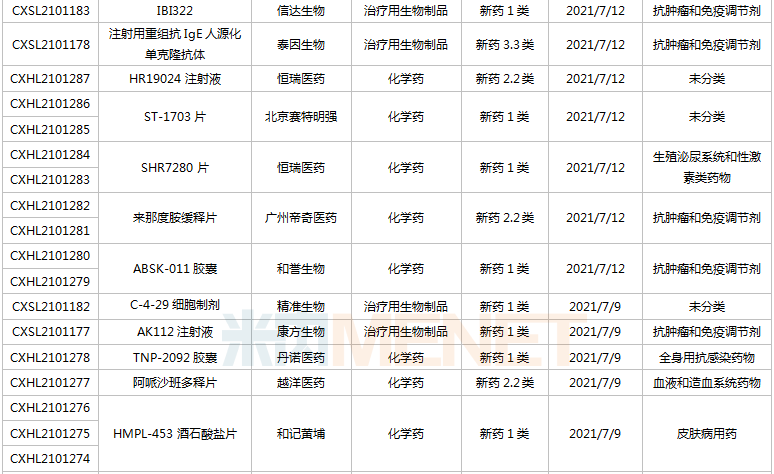 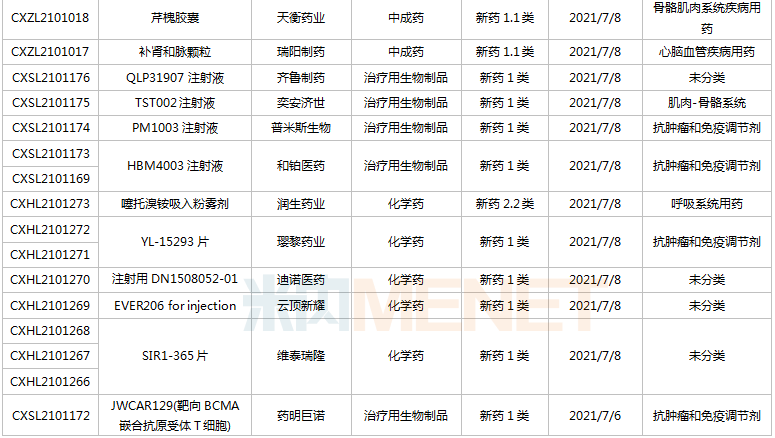    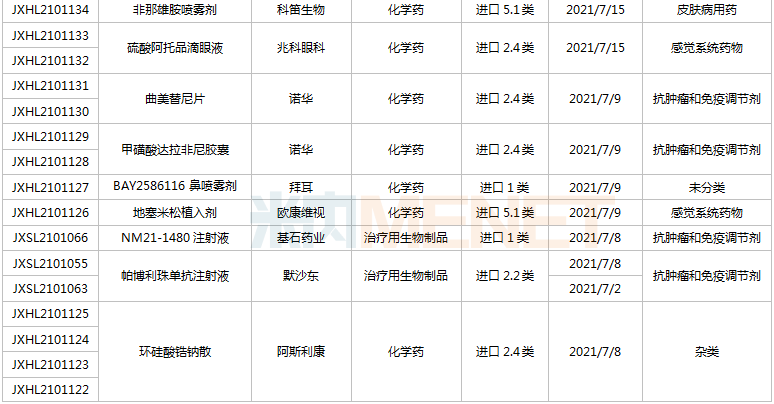   豪森藥業有4款新藥申請臨床,包括HS-10241片、甲磺酸阿美替尼片、注射用HS-20089及注射用HS-20093,其中注射用HS-20089、注射用HS-20093為首次申報,兩款新藥均為治療用生物制品。
基石藥業首次申報臨床的NM21-1480注射液(原代號ND021)是一款針對三個靶點的多特異性抗體,可以同時結合PD-L1與4-1BB,并且還可以結合人血清白蛋白(HSA),ND021獨特的單價結構使其在安全窗和抗癌譜方面具備很大的優勢。
君實的JS014注射液屬于重組白介素21-抗人血清白蛋白(HSA)單域抗體融合蛋白,通過融合抗HSA的單域抗體使IL-21的半衰期得到顯著延長,是國內首款申報臨床的IL-21融合蛋白。
阿斯利康首次申報臨床的AZD5305屬于第二代PARP抑制劑,對PARP1具有高度選擇性,同時還是高效的PARP1-DNA捕獲器,解決了第一代PARP抑制劑與化療藥物聯合使用時的毒副作用。
諾和諾德的NNC0385-0434片是國內第3款申報臨床的口服PCSK9抑制劑,另外2款為西威埃醫藥的CVI-LM001和中科院上海藥物研究所的DC371739。目前國內2款PCSK9抑制劑獲批上市,均為注射劑,分別是賽諾菲的阿利西尤單抗和安進的伊洛尤單抗,暫無口服PCSK9抑制劑獲批。
數據來源:米內網數據庫、CDE、公司公告。數據統計時間段為6月26日-7月16日,按藥品名稱統計(不含預防用生物制品、體外診斷試劑等,不含補充申請),如有疏漏,歡迎指正!
注:米內網中國城市實體藥店終端競爭格局數據庫是覆蓋全國293個地市及以上城市實體藥店(不含縣鄉村實體藥店),對全品類進行連續監測的放大版城市實體藥店數據庫。上述銷售額以產品在終端的平均零售價計算。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|