
|
|
|||||
|
||||||
中藥新藥審評提速 政策引爆市場行情摘要:
在醫保續約談判中,中成藥降幅相比更加溫和。
醫保支付端,未來對中藥的支付會更加清晰。
中藥新藥審批速度不斷加快,未來幾年,中藥新藥每年審批上市的數量一定不會少于2021年的12家。
未來3-5年,將進入混亂的中藥創新資源爭奪。
《國家醫療保障局國家中醫藥管理局關于醫保支持中醫藥傳承創新發展的指導意見》,是2021年底及2022年初引爆整個中藥行業在二級市場表現的重要因素之一。
在2022年2月21日由E藥經理人主辦的中國醫藥產業新年展望會上,華安證券醫藥首席分析師譚國超,就《中藥創新藥:踏時代浪潮,創新中藥曙光初現》這一深度報告進行了分享。報告分別從政策、支付、申報、審批、臨床等方面對中醫藥的創新發展進行了闡述。
01.政策逐漸明確,引爆中藥市場行情
縱觀中醫藥的政策發布歷程,譚國超表示,2019年是比較重要的一年,《關于促進中醫藥傳承創新發展的意見》出臺,這為未來國家中醫藥的創新奠定了政策基礎。
2020年至2021年中藥創新藥的支持政策不斷落地。期間,國家藥監部門對中藥注冊進行了明確的分類。
譚國超表示,讓中藥在2021年年底及2022年年初引起社會廣泛關注的關鍵是,2021年12月30日,國家醫保局、國家中醫藥管理局發布的《國家醫療保障局國家中醫藥管理局關于醫保支持中醫藥傳承創新發展的指導意見》(以下簡稱《意見》)。
譚國超在分享中指出,這個文件,是引爆整個中藥行業在二級市場表現的重要因素之一,《意見》對中藥給與了更多的支持。
《意見》從醫保方面對中醫藥傳承,做了比較明確的落地,包括將符合條件的中醫醫療機構納入醫保定點,并且對中醫的醫療服務價格進行管理,簡化新增的價格項目審批程序,開辟了一些綠色通道。
譚國超強調,其中值得重點關注的是,公立醫療機構從正規渠道采購中藥飲片,嚴格按照實際購進價格順加不超25%銷售,“這讓我們耳目一新”。
譚國超介紹,此前一些中藥和中醫醫療服務,并沒有被明確的納入醫保程序,但是在這個《意見》中,將包括中成藥、中藥制劑都會按照規定歸納到醫保目錄,并且也會經過國家醫保談判,將他們納入到醫保目錄,并且得到國家更加直接的監管。并且在《意見》中,還提出中醫醫療機構可以暫時不按照DRG 來收費和付費。
而在2022年年初,CDE就發布了基于“三結合(中醫藥理論、人用經驗、臨床試驗)”注冊審評證據體系下的溝通交流技術指導原則(征求意見稿)。這一原則,是對2019 年 10 月印發的《中共中央 國務院關于促進中醫藥 傳承創新發展的意見》提出“構建中醫藥理論、人用經驗、 臨床試驗相結合的中藥注冊審評證據體系”的落地和細化。譚國超認為,這一政策,尊重中藥研發規律,將中藥的審評審批區分于化藥藥品的注冊審評體系,值得重視。
此外,CDE還發布了中藥新藥毒理研究的指導原則,這都對中藥創新藥的臨床注冊,以及后面的藥理都做了較為明確的規定和研究。政策還逐漸放開了非中醫的處方權。上海衛健委已經發布政策,非中醫類的執業醫師,可以開展中醫診療活動。此前只有中醫執業醫師,才可以開中藥藥方,現在只要是通過中醫藥相關培訓考核,也具備中醫診療活動資格,這也是對中藥發展的一大拓展。
而在國際化上,國家也希望借助“一帶一路”路徑,推進中醫藥能夠往國際化發展,希望能夠打造10個中醫藥的文化海外傳播項目,50個中醫藥國際合作基地等等,這些都是國家在政策方面對中藥的支持。
02.醫保續約談判降價更為緩和,支付端優勢顯現
在支付端,2017-2021年的醫保談判中,中藥優勢逐步顯現。
數據顯示,2017-2020年中藥納入醫保的比例逐年攀升,2021年中藥醫保入圍后的中標率(84%)高于西藥入圍后的中標率(53%)。同時,2021年12月發布的中藥政策在中醫醫藥機構、中藥藥品醫保納入等方面給予指導,并指出中醫醫療機構可暫不實行DRG付費。
在監管方面,建立健全適應中醫藥服務特點的制度也是《意見》工作重心之一。整體來看,支付端對于中藥的扶持逐步加強。
另外在續標的降幅上來看,中藥的降幅相對緩和。例如,在以下“2021年醫保談判中續約”的23個產品中,其中僅有有5個產品有降價,其他產品的價格處于基本持平狀態。
其中,僅有神威藥業的芪黃通秘軟膠囊,降幅超過了10%,為12.86%,上海凱寶的痰熱清膠囊價格下降了3.89%。
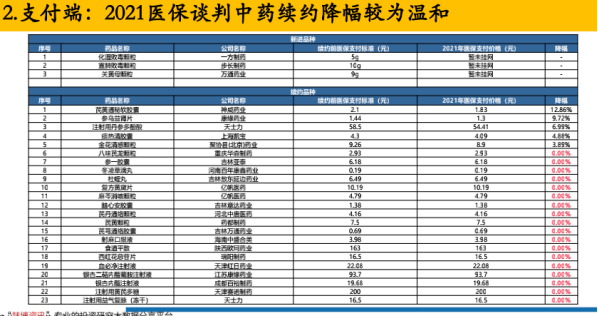 此前中藥獲批品類在醫保中大多屬于醫保乙類,譚國超表示,相信隨著中藥創新的推進,以及國家支持力度的增加,相信對中藥創新藥之后進醫保,及如何報銷,以及后期的醫保談判,一定會有更加明確的方案,很值得期待。
03.尊重中藥特點,審批注冊更加明細
在中藥的審批端,從2017年至2021年一共批準了20款中藥創新藥,但是2021年一共批準了12個,也就是說2017年至2020年僅批準了8個中藥新藥。
這一數字的變化背后是國家對中藥新藥分類的進一步明確和細化。
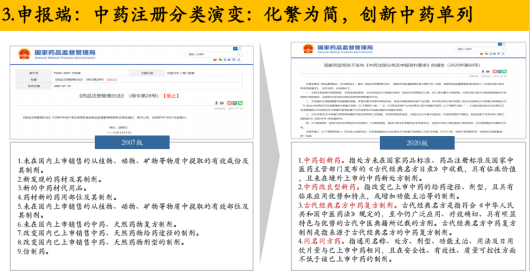 譚國超表示,2007年和2020年是兩個比較明確的時間點,中藥注冊分類不斷化繁為簡,并將創新中藥單列其中。
2007年時,中藥的注冊分類比較粗獷,但是2020年的藥品注冊管理辦法中,對
中藥創新藥更加明確,特指處方未在國家藥品標準、藥品注冊標準及國家中醫藥主管部門發布的《古代經典名方目錄》中收載,具有臨床價值,且未在境外上市的中藥新處方制劑。
對中藥改良型新藥也進行了明確,指改變已上市中藥的給藥途徑、劑型,且具有
臨床應用優勢和特點,或增加功能主治等的制劑。
古代經典名方中藥復方制劑也做了明確,指符合《中華人民共和國中醫藥法》規定的,至今仍廣泛應用、療效確切、具有明顯特色與優勢的古代中醫典籍所記載的方劑。古代經典名方中藥復方制劑是指來源于古代經典名方的中藥復方制劑。
“2020年的中藥注冊分類,不僅考慮到了中藥的特點,也注重了傳承,也結合了中藥創新的因素,更加強調臨床價值”,不再是以單純的物質基礎為依據,結合了中醫理論以及臨床經驗作為依據,這是很大的不同。
中藥注冊分類變得更加清晰,目前新藥的申報資料對一些中藥的注冊,還給與一些減免政策。例如,一些已經有人用經驗的中藥方制劑,它可以根據人用經驗的有效,可以適當減免藥效學的實驗。此外一些增加功能的藥物,也可以根據人用經驗,減少部分實驗,還有倫理學也同樣的情況,“但是,一定要提前與藥監部門做足夠多的溝通和交流,”譚國超建議。整體來看,中藥注冊,更加注重真實世界研究,例如國家藥監局海南真實世界數據研究與評價重點實驗室正式落成,這也是對中藥創新產品的一大利好。
04.中藥新藥上市加速,中藥創新趨勢良好
從以上政策的結果來看,中藥新藥審批的速度,“有加速,并且加速特別快”,譚國超在演講中表示。
歷史數據顯示,2017年,一款中藥創新藥的審批甚至需要3600天,2018年縮短,不到2000天,2021年加速趨勢更加明顯,大多300天就能獲批上市。上市時間縮短了90%。而2022年獲批上市的,抗癌新藥淫羊藿素軟膠囊,甚至僅用不到300天就獲批上市。
譚國超表示,未來中藥創新藥審批上市速度會進一步縮短,以這一速度預判,未來幾年內,中藥新藥每年審批的數量一定不會少于2021年的12家。
數據顯示,中藥創新趨勢良好。2016-2021年一共申請臨床191項目,近3年來臨床數目逐年增多,2021年中藥創新藥臨床申請占比為65%,是2020年的2倍 ,2019年的5倍左右。改良型中藥、復方制劑、同名同方藥等占比趨于下調。
2016-2021共申報399項臨床試驗,其中消化系統疾病、感染性疾病、循環系統疾病、呼吸系統疾病占比較高。2021年共申報82項,其中消化系統疾病、循環系統疾病、感染性疾病仍然占據較大比重。
2014-2021年國內共開展905項中藥相關臨床研究,其中2014-2015年大量臨床的設立為后續中藥臨床開展打下了堅實的基 礎。近3年來看,伴隨著創新藥的大浪潮,中藥III期臨床比例逐步提升,非標準分期研究逐步減少,早期科研轉化趨勢 良好,循證醫學證據不斷豐富。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|