
|
|
|||||
|
||||||
同名同方藥注冊開閘在望 中藥仿制切中痛點厲兵秣馬摘要:
中藥仿制藥涉及2017版《中藥、天然藥物注冊分類及申報資料要求》中藥分類第9類,以及2020版《中藥注冊分類及申報資料要求》的同名同方藥。
根據2007年版《藥品注冊管理辦法》附件《中藥、天然藥物注冊分類及申報資料要求》,當時的中藥分類第9類是仿制藥,是指注冊申請我國已批準上市銷售的中藥或天然藥物。
而根據2020年發布的《中藥注冊分類及申報資料要求》,同名同方藥是指通用名稱、處方、劑型、功能主治、用法及日用飲片量與已上市中藥相同,且在安全性、有效性、質量可控性方面不低于該已上市中藥的制劑。
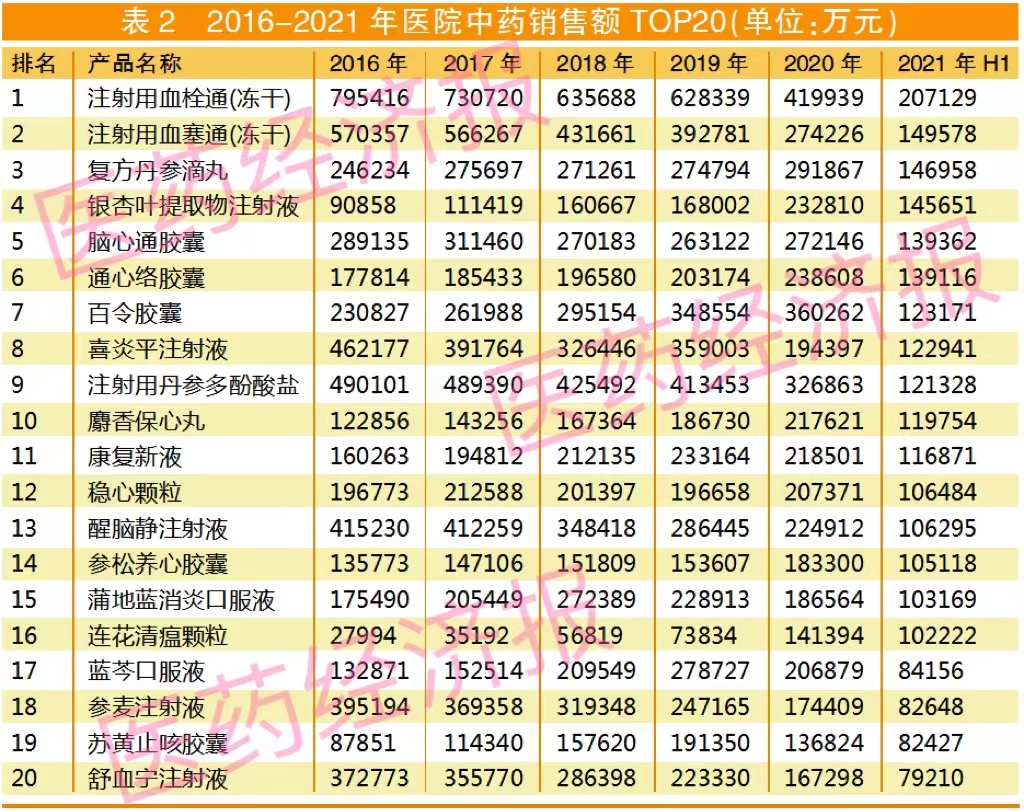
而如表1所示,2014年以來,中藥仿制藥每年申報數量都未超過10個,最主要的原因是2014年以來申報的中藥仿制藥基本沒有獲批,業界失去開發中藥仿制藥的意愿。
 但與此同時,中藥仿制藥的限制注冊給了獨家中藥一個良好的生存空間,這導致獨家中藥無論是批文交易還是產品市場方面,都是業界愿意投資的方向。
據悉,同名同方藥會在近期放開注冊限制。這意味著中藥產品的市場格局有可能被打破。過往對中藥的保護政策基本上也已到期,獨家中藥除非有專利保護,否則會有被仿制的風險。
立項關注點
同名同方藥應提供同名同方的已上市中藥的相關信息(如上市許可持有人、藥品批準文號、執行標準等)以及選擇依據,簡述與同名同方的已上市中藥在處方、工藝以及質量控制等方面的對比情況,并說明是否一致。
同名同方藥還應說明與同名同方的已上市中藥生產工藝的對比情況,并說明是否一致。同名同方藥應提供與同名同方已上市中藥的質量對比研究結果。若為同名同方藥的緩、控釋制劑,應進行非臨床藥代動力學比較研究。
同名同方藥參比品如何選?
按照化學藥,仿制藥通常仿制的是參比制劑。那么,對于已經上市多家的中藥來說,同名同方藥是否只要選擇任何一個已上市的中藥作為參比制劑就可以了?即使是同名同方藥,不同的方可能工藝、組方和質量標準都不同,選擇不同的產品仿制,最后如何區隔?中藥選擇代表產品仿制時,以什么為標準?此外,還需要確定的重要問題是:質量標準的制定單位是誰?是首家上市產品,還是市場銷售最好的產品?這些細節受關注。
未納入中國藥典產品怎么仿?
對于獨家產品來說,它們的質量標準和工藝如果沒有納入中國藥典,仿制藥廠家就很難獲得其工藝標準和質量。
這意味著首批中藥仿制藥很有可能就是中國藥典納入品種中賣得好的獨家產品。
含獨特藥材品種難仿制
鑒于中藥的藥用部位成分復雜,影響中藥質量一致的因素多,不像仿制藥那樣,只要解決好原輔包和工藝,仿制藥基本就能與參比制劑一致了。中藥仿制,則需要考慮藥材的來源與參比藥一致,即藥材的種屬和產地都要一致,才能減少偏差。對于一些已經掌握當地藥材資源的參比制劑來說,既掌握了成本也掌握了原料,未來集采還是有可能繼續維持現有的價格優勢。這也意味著,含有一些獨特藥材的中藥很難被仿制。
"雙通道"焦點
中藥注射劑:醫院最想仿制類別
即使面臨臨床限制的壓力,獨家中藥注射劑近幾年銷售依然排名前列。如果同名同方注射放開,預計業界最想仿制的類別會是中藥注射劑。對于中藥注射劑仿制,配套政策預期方面,有哪些業界關注的細節?
按照舊法規,申請仿制藥只有中藥、天然藥物注射劑等需進行臨床試驗,生物利用度試驗一般為18~24例,仿制藥根據評價需要,進行不少于100對臨床試驗。
 舊法規還單獨提出中藥、天然藥物注射劑的技術要求:中藥、天然藥物注射劑的研發應符合臨床治療和藥物性質的需要。應該提供充分的依據說明注射給藥優于其他非注射給藥途徑,應在有效性或安全性方面體現出明顯優勢;與已上市的其他同一給藥途徑、同類功能主治(適應癥)的注射劑進行比較,在有效性或安全性等方面具有一定優勢或特色;單一有效成分制成的注射劑需要提供藥代動力學的依據;多成分制成的注射劑需要進行藥代動力學探索性研究;有效成分制成的復方注射劑及多成分制成的注射劑需進行各組分組方合理性的相關研究,來自同一藥材的同一工藝制備得到的多成分注射劑除外;注射劑中所含成分應基本清楚。此外,應對注射劑總固體中所含成分進行系統的化學研究;有效成分制成的注射劑,其單一成分含量應不少于90%;多成分制成的注射劑,總固體中結構明確成分的含量應不少于60%。
當時的法規要求仿制藥應與被仿制品種質量標準一致,必要時還應提高質量標準。復方注射劑處方中,如果包含已上市注射劑的處方,且其功能主治(適應癥)基本一致者,應進行非臨床及臨床對比研究,以說明新處方注射劑在安全性或有效性方面優于原已上市的注射劑,并優于已上市的相同給藥途徑、同類功能主治(適應癥)的產品。
OTC和補益類:藥店銷售前排品類
 生物等效性研究啟動的難點,最主要的是參比制劑的標準尚未確定,生物等效性研究也沒有歐美日的指導原則可以參考。而體外溶出數據證明一致性,這本身也是很困難的。
此外,感冒靈這類含有化學成分的中成藥如何仿制,也是業界討論的焦點之一。
小結
同名同方藥上市后,集采規則偏向生物制品規則還是化學藥規則?從成分的復雜性、臨床可替代性來看,預計集采規則會偏向于現有的生物制品規則和各省的中藥集采規則,設AB采購單,即更利于已上市的中藥,而不是像化學仿制藥那樣直接可以替換參比制劑。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|